题目内容
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
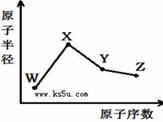
A. 最高化合价X>Y>Z>W
B. 气态氢化物的稳定性Z>Y>W
C. Y的氧化物与X、Z的最高价氧化物对应的水化物均能反应
D. X、Z、W三种元素形成的化合物一定既含离子键又含共价键
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
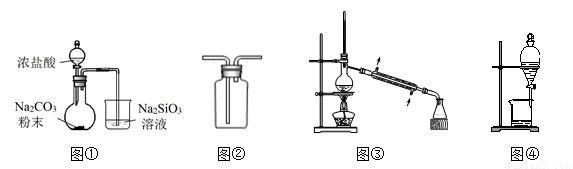
轻松课堂单元测试AB卷系列答案海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。

(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
将Br2与Na2CO3反应的化学方程式补充完整:
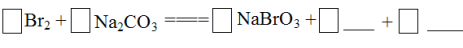
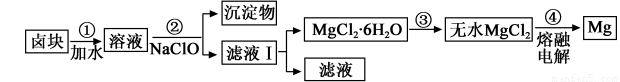
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
② 用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③ 步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因____________。
④ NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗NaClO g。
在一体积固定的密闭容器中,进行化学反应:2X(g) + Y(s) Z(g) + W(g);若其化学平衡常数(K)和温度(t)的关系如下表:
Z(g) + W(g);若其化学平衡常数(K)和温度(t)的关系如下表:
t/℃ | 700 | 800 | 900 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.3 | 1.8 | 2.7 |
对该反应而言,下列说法正确的是 ( )
A. 该反应正反应为放热反应
B.起始浓度不变,K越大,反应物的转化率越大
C.温度不变,增加X的用量,K增大
D.达平衡后,加入催化剂,K增大