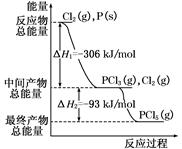
题目内容
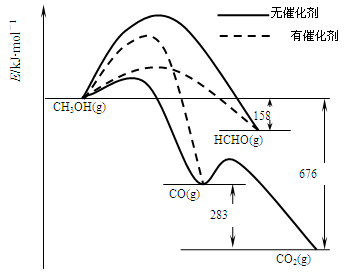
(10分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1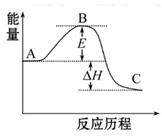
请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;
(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物VO2;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH_______(要求计算过程)。
(1)反应物能量 生成物能量 没有影响 降低 因为催化剂改变了反应历程,使活化能E降低 (2)-198(3)SO2+V2O5===SO3+2VO2 4VO2+O2===2V2O5
(4) S(s)+O2(g) === SO2(g) ΔH1="-296" kJ·mol-1①
SO2(g)+1/2 O2(g) === SO3(g) ΔH2="-99" kJ·mol-1②
①×3+②×3得
3S(s)+9/2 O2(g) ===3SO3(g) ΔH=(ΔH1+ΔH2)×3=-1185kJmol-1
解析试题分析:(1)E表示活化能,反应热只取决于反应物所具有的能量和生成物所具有的能量差,与活化能的大小无关;一般是催化剂改变反应的历程,降低反应的活化能,使反应速率加快; (2)图中表示2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化,因为1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1,故2mol时热量也加倍,故为198;(3)催化剂反应前后质量和化学性质均不变,故V2O5氧化SO2生成三氧化硫,自身被还原为四价钒氧化物VO2,写出化学方程式;四价钒氧化物再被氧气氧化为V2O5,写出化学方程式;(4)先写出硫燃烧生成二氧化硫的化学方程式,再写出二氧化硫生成三氧化硫的热化学方程式,根据盖斯定律计算可得。
2SO3(g)反应过程的能量变化,因为1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1,故2mol时热量也加倍,故为198;(3)催化剂反应前后质量和化学性质均不变,故V2O5氧化SO2生成三氧化硫,自身被还原为四价钒氧化物VO2,写出化学方程式;四价钒氧化物再被氧气氧化为V2O5,写出化学方程式;(4)先写出硫燃烧生成二氧化硫的化学方程式,再写出二氧化硫生成三氧化硫的热化学方程式,根据盖斯定律计算可得。
考点:催化剂的作用、化学方程式的书写、反应热的计算等知识。

下列反应中属吸热反应的是
| A.铝与盐酸反应放出氢气 | B.氢氧化钠与盐酸的反应 |
| C.硫在空气或氧气中燃烧 | D.Ba(OH)2·8H2O与NH4Cl反应 |
已知;①Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
②Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=b kJ·mol-1。
测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(2)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(3)下列关于反应①的说法正确的是 。
A.达到平衡后保持其他条件不变,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 在500 ℃下反应,当c(CO2)=c(CO)时,反应达到平衡状态
C.恒温恒容下,当容器内气体密度不再变化时,反应达到平衡状态
D.加压、升温和使用催化剂均可增大反应物的转化率
(4)由已知反应,写出Fe2O3(s)被CO(g)还原成FeO(s)的热化学方程式 。
(5)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-36)。
(6)新型锌空电池与锂电池相比,具有能量密度高、安全性好且成本低。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为_______。
若以该电池为电源,用惰性电极电解硫酸铜溶液,为保证阴极有6.4g铜析出,理论上至少需要标准状况下 L空气(空气中含氧气按20%计算)进入该电池。
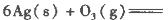
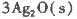 反应生成3 mol Ag2O(s)时放出的热量为
反应生成3 mol Ag2O(s)时放出的热量为
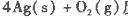 反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
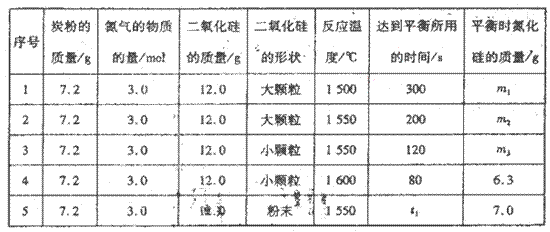

 H
H
 请在答题卡上写出并配平反应式(a);
请在答题卡上写出并配平反应式(a);