题目内容
(10分)甲醇合成反应为:CO(g)+2H2(g) CH3OH(g)
工业上用天然气为原料,分为两阶段制备甲醇:
(1)制备合成气:CH4+H2O(g) CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO3+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为____________________________________。
(2)合成甲醇:①反应过程中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。
实验室在1L密闭容器中进行模拟合成实验。将lmolCO和2molH2通人容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:
(表中数据单位:mol·L—1)
②300℃时反应开始10分钟内,H2的平均反应速率为__________。
③500℃时平衡常数K的数值为___________。
④300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系 产生的影响是__________(填字母)。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时c(H2)/c(CH3OH)减小
(1)3:1(2分)
(2)①![]()
 (2分)
(2分)
②0.080mol/(L·min)(2分) ③25(2分) ④c、d(全对2分,多选1个倒扣1分)
解析:略

甲醇合成反应为:![]() 工业上用天然气为原料,分为两阶段:
工业上用天然气为原料,分为两阶段:
 Ⅰ、制备合成气:
Ⅰ、制备合成气:![]() 。为解决合成气中H2过量CO不足问题,原料气中添加CO2:
。为解决合成气中H2过量CO不足问题,原料气中添加CO2:![]() 。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________
。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________
Ⅱ、合成甲醇:(1)反应过程中物质能量变化如右图所示。
写出合成甲醇的热化学方程式_________________。
![]()
实验室在1L密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在300℃和500℃ 反应,每隔一定时间测得容器中甲醇的浓度如下:![]()
![]()
| 10min | 20min | 30min | 40min | 50min | 60min |
300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(2)在300℃ 反应开始10分钟内,H2的平均反应速率_____________
(3)500℃ 平衡常数K=___________
(4)在另一体积不变的容器中,充入1.2molCO2和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半。计算该条件下H2转化率。(写出计算过程)
 (2009?深圳二模)甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段:
(2009?深圳二模)甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段: 甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇:
甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇: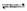 CH3OH(g)
CH3OH(g)
 ②300℃时反应开始10分钟内,H2的平均反应速率为__________。
②300℃时反应开始10分钟内,H2的平均反应速率为__________。