题目内容
4.对下列化学反应先后顺序判断正确的是( )| A. | 在含Al3+、H+的溶液中缓慢滴加NaOH溶液:Al3+、H+ | |
| B. | 在含SiO32-的溶液缓慢滴加稀盐酸:SiO32-、CO32- | |
| C. | 在含Br-、Fe2+的溶液中缓慢通入氯气:Br-、Fe2+ | |
| D. | 在含有Cu2+、Fe3+的溶液中加入锌粉:Cu2-、Fe3+ |
分析 A.酸性强的与NaOH先反应;
B.弱酸跟越弱越易与氢离子结合;
C.还原性强的先被氯气氧化;
D.氧化性强的先与Fe反应.
解答 解:A.酸性由强到弱为H+、A13+、Al(OH)3,则逐滴加入NaOH溶液,反应先后顺序为H+、A13+、Al(OH)3,故A错误;
B.水解程度强到弱为SiO32-、CO32-,则缓慢滴加稀盐酸,反应先后顺序为SiO32-、CO32-,故B正确;
C.还原性由强到弱为Fe2+、Br-,则缓慢通入氯气的先后顺序为Fe2+、Br-,故C错误;
D.氧化性为Fe3+>Cu2+,则加入铁粉反应的先后顺序为Fe3+、Cu2+,故D错误;
故选B.
点评 本题考查反应的先后顺序,为高频考点,把握酸性、还原性、氧化性、溶度积等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
4.已知A--F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
(1)写出符合下列条件的A的同分异构体的结构简式: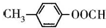 .
.
A.核磁共振氢谱有4组峰
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
(2)化合物B是制取抗心律失常药物--氟卡尼的中间体,下列有关描述不正确的是BD(填字母).
A.能与氯化铁溶液显色 B.分子中含有羧基、羟基等官能团
C.能与溴水反应 D.能与碳酸钠溶液反应产生二氧化碳
(3)化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为3mol.
(4)化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去.
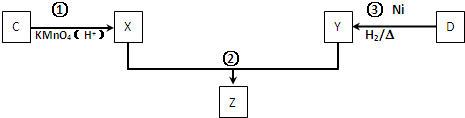
反应③中D与H2按物质的量1:1反应生成Y,则反应②的化学方程式为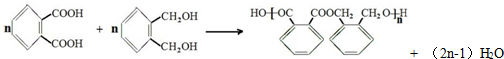 .
.
(5)化合物D与银氨溶液反应的化学方程式(有机物用结构简式表示):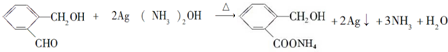 .
.
(6)化合物F是合成克矽平的原料之一,(克矽平是一种治疗矽肺病的药物),其合成路线如下(反应均在一定条件下进行):
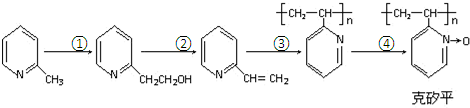
a.反应①是原子利用率100%的反应,则该反应的化学方程式为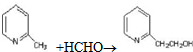 ;
;
b.上述转化关系中没有涉及的反应类型是③⑥(填代号).
①加成反应 ②消去反应 ③还原反应 ④氧化反应 ⑤加聚反应 ⑥取代反应.
| 化合物 | A | B | C |
| 结构简式 | 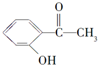 | 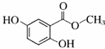 | 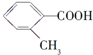 |
| 化合物 | D | E | F |
| 结构简式 |  | 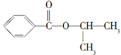 |  |
 .
.A.核磁共振氢谱有4组峰
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
(2)化合物B是制取抗心律失常药物--氟卡尼的中间体,下列有关描述不正确的是BD(填字母).
A.能与氯化铁溶液显色 B.分子中含有羧基、羟基等官能团
C.能与溴水反应 D.能与碳酸钠溶液反应产生二氧化碳
(3)化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为3mol.
(4)化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去.

反应③中D与H2按物质的量1:1反应生成Y,则反应②的化学方程式为
 .
.(5)化合物D与银氨溶液反应的化学方程式(有机物用结构简式表示):
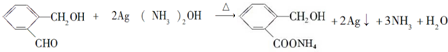 .
.(6)化合物F是合成克矽平的原料之一,(克矽平是一种治疗矽肺病的药物),其合成路线如下(反应均在一定条件下进行):

a.反应①是原子利用率100%的反应,则该反应的化学方程式为
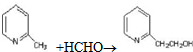 ;
;b.上述转化关系中没有涉及的反应类型是③⑥(填代号).
①加成反应 ②消去反应 ③还原反应 ④氧化反应 ⑤加聚反应 ⑥取代反应.
5.下列实验方案可以得到白色纯净的Fe(OH)2的是( )
| A. | 在Fe2(SO4)3溶液中加入过量的铁粉,过滤,在滤液中加入过量的NaOH溶液 | |
| B. | 用铁粉与稀硫酸充分反应,然后再加入过量的氨水 | |
| C. | 在FeCl2溶液上加一层苯,然后将滴管插入到FeCl2溶液液面以下,慢慢滴加NaOH溶液(溶液中不能有气泡,配制FeCl2和NaOH溶液的蒸馏水必须加热煮沸) | |
| D. | 在生成Fe(OH)3的悬浊液中加过量的铁粉 |
12.实验室制取乙烯的传统做法是采用浓硫酸做催化剂,由于浓硫酸具有具有脱水性和强氧性,生成乙烯同时产生CO2和SO2气体会影响乙烯的性质实验.某同学查阅相关资料后发现,可用脱水性更强的P2O5代替浓硫酸浓硫酸作为该实验的催化剂.为验证这一说法,该同学利用以下装置进行实验探究,观察并记录现象如下:

请回答下列问题:
(1)写出装置中仪器A的名称分液漏斗;
(2)装置中B、C之间长导管的作用是导气、冷凝,浓硫酸的作用是干燥气体;
(3)实验二中,完成水浴加热必需的玻璃仪器有大烧杯、酒精灯;
(4)实验一、二中当加入无水乙醇时,均有白雾产生,请简述产生白雾的原因:P2O5溶解于乙醇,迅速放出大量的热,局部温度较高,使得少量乙醇气化,形成白雾;
(5)经检验集气瓶C中无色液体为磷酸三乙酯,请在图中虚线框内画出实验装置(含试剂)用于验证生成的乙烯;
(6)根据实验现象判断以P2O5作为催化剂获得乙烯的反应条件是加热至较高温度.

| 实验一 | 实验二 | |
| 实验药品 | 4g P2O5、8mL无水乙醇 | |
| 实验条件 | 酒精灯加热 | 水浴加热 |
实验现象 | 无水乙醇加入时,圆底烧瓶B中P2O5溶于乙醇,立即产生白雾,当用酒精灯加热后,有气泡产生,并逐渐沸腾,生成粘稠状液体,集气瓶C中有无色液体产生. | 无水乙醇加入时,圆底烧瓶B中P2O5溶于乙醇立即产生白雾,当用水浴加热后,无气泡产生,生成粘稠状液体,集气瓶C中有无色液体产生. |
(1)写出装置中仪器A的名称分液漏斗;
(2)装置中B、C之间长导管的作用是导气、冷凝,浓硫酸的作用是干燥气体;
(3)实验二中,完成水浴加热必需的玻璃仪器有大烧杯、酒精灯;
(4)实验一、二中当加入无水乙醇时,均有白雾产生,请简述产生白雾的原因:P2O5溶解于乙醇,迅速放出大量的热,局部温度较高,使得少量乙醇气化,形成白雾;
(5)经检验集气瓶C中无色液体为磷酸三乙酯,请在图中虚线框内画出实验装置(含试剂)用于验证生成的乙烯;
(6)根据实验现象判断以P2O5作为催化剂获得乙烯的反应条件是加热至较高温度.
19.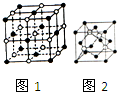 钠和铜的单质及其化合物在生活实际中有着广泛的应用.
钠和铜的单质及其化合物在生活实际中有着广泛的应用.
(1)Cu2+基态的核外电子排布式为1s22s22p63s23p63d9;
(2)NaCl晶体的晶胞结构如图1所示,在NaCl的晶胞中含有的阴离子的个数为4,阳离子的配位数为6;
(3)钠的有关卤化物的熔点间下表,钠的卤化物熔点按NaF、NaCL、NaBr、NaI顺序降低的原因是氟离子、氯离子、溴离子、碘离子的半径变小,所以NaF、NaCL、NaBr、NaI晶体的晶格能变小,所以熔点降低;
(4)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如图2所示,则A的化学式是CuI,A中铜元素的化合价为+1.
 钠和铜的单质及其化合物在生活实际中有着广泛的应用.
钠和铜的单质及其化合物在生活实际中有着广泛的应用.(1)Cu2+基态的核外电子排布式为1s22s22p63s23p63d9;
(2)NaCl晶体的晶胞结构如图1所示,在NaCl的晶胞中含有的阴离子的个数为4,阳离子的配位数为6;
(3)钠的有关卤化物的熔点间下表,钠的卤化物熔点按NaF、NaCL、NaBr、NaI顺序降低的原因是氟离子、氯离子、溴离子、碘离子的半径变小,所以NaF、NaCL、NaBr、NaI晶体的晶格能变小,所以熔点降低;
| NaF | NaCl | NaBr | NaI | |
| 熔点/℃ | 993 | 801 | 747 | 661 |
16.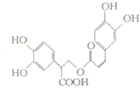 迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )
迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )
 迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )
迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )| A. | 7:6:1 | B. | 7:6:5 | C. | 6:7:1 | D. | 6:7:5 |
13.下列物质中,属于弱电解释的是( )
| A. | 氨水 | B. | SO2 | C. | CH3COOH | D. | BaSO4 |
14.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.01 mol/(L•min) | D. | v(NH3)=0.17 mol/(L•min) |
 在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如图所示,则每个晶胞中含有的氧原子数为( )
在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如图所示,则每个晶胞中含有的氧原子数为( )