题目内容
往100 mL,pH=0的硫酸和硝酸的混合液中投入3.84 g铜粉,充分反应后,生成NO气体,标准状况下为448 mL,则反应前的混合液中HNO3的物质的量是( )
| A.0.02 mol | B.0.08 mol |
| C.0.10 mol | D.0.16 mol |
A
3Cu + 8H++2N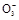
 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
3 8 2
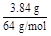 ="0.06" mol 0.1 mol
="0.06" mol 0.1 mol 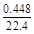 ="0.02" mol
="0.02" mol
故H+过量,N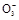 完全反应,n(HNO3)="n(NO)=0.02" mol。
完全反应,n(HNO3)="n(NO)=0.02" mol。
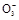
 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O3 8 2
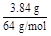 ="0.06" mol 0.1 mol
="0.06" mol 0.1 mol 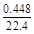 ="0.02" mol
="0.02" mol故H+过量,N
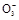 完全反应,n(HNO3)="n(NO)=0.02" mol。
完全反应,n(HNO3)="n(NO)=0.02" mol。
练习册系列答案
相关题目
 6Cu+SO2↑反应中,说法正确的是( )
6Cu+SO2↑反应中,说法正确的是( )
 ),聚丙烯酸钾单体的结构简式为 。
),聚丙烯酸钾单体的结构简式为 。