题目内容
13.对乙酰氨基苯酚I( )是最常用的非甾体消炎解热镇痛药,可用如下方法合成:
)是最常用的非甾体消炎解热镇痛药,可用如下方法合成:
请回答下列问题:
(1)A.B.C.D.E中能使酸性高锰酸钾溶液褪色的物质为CH3CH2OH、CH3CHO(写结构简式),H所含官能团的名称是羟基和氨基;
(2)①②③④中属于取代反应的是③、④;
(3)关于I的说法不正确的是abcd
a.1mol的I与氢氧化钠反应消耗1mol氢氧化钠
b.1mol的I与氢气反应消耗4mol氢气
c.可与溴水发生加成反应
d.分子中的所有原子共面
(4)写出符合下列条件的D的同分异构体

①五元环化合物;②含酯基;③可与金属钠反应产生氢气.
(5)写出反应④的化学方程式:
 .
.
分析 根据题中各物质转化关系,A氧化得B,B氧化得C,根据B、C的分子式可知,A为CH3CH2OH,B为CH3CHO,C为CH3COOH,2分子C脱1分子水发生取代反应得D为乙酸酐,E在浓硫酸和浓硝酸的作用下生成硝基苯,所以E为苯,苯发生取代反应生成硝基苯,F还原得G,G重排得H,对氨基苯酚与乙酸酐发生取代反应得I为 ,据此答题.
,据此答题.
解答 解:根据题中各物质转化关系,A氧化得B,B氧化得C,根据B、C的分子式可知,A为CH3CH2OH,B为CH3CHO,C为CH3COOH,2分子C脱1分子水发生取代反应得D为乙酸酐,E在浓硫酸和浓硝酸的作用下生成硝基苯,所以E为苯,苯发生取代反应生成硝基苯,F还原得G,G重排得H,对氨基苯酚与乙酸酐发生取代反应得I为 ,
,
(1)根据上面的分析可知,在A.B.C.D.E中能使酸性高锰酸钾溶液褪色的物质为CH3CH2OH、CH3CHO,根据H的结构简式可知,H所含官能团的名称是羟基和氨基,
故答案为:CH3CH2OH、CH3CHO;羟基和氨基;
(2)①②③④中属于取代反应的是③、④,
故答案为:③、④;
(3)I为 ,
,
a.1mol的I与氢氧化钠反应消耗2mol氢氧化钠,故a错误;
b.1mol的I与氢气反应消耗3mol氢气,故b错误;
c.可与溴水发生取代反应,故c错误;
d.分子中有甲基,所以分子中所有原子不可能共面,故d错误;
故选abcd;
(4)根据D的结构简式,结合条件①五元环化合物;②含酯基;③可与金属钠反应产生氢气,说明有羟基或羧基,符合条件的结构为 ,
,
故答案为: ;
;
(5)反应④为对氨基苯酚与乙酸酐发生取代反应得I,反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断和合成,为高频考点,把握合成流程这发生的反应、官能团的变化、有机物结构与性质为解答的关键,侧重分析与应用能力的考查,题目难度中等.

| A. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| B. | 向苯酚溶液中滴加Na2CO3溶液: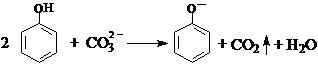 | |
| C. | 2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA | |
| D. | 苯的同系物能使酸性高锰酸钾溶液褪色,说明烃基对苯环的性质产生了较大的影响 |
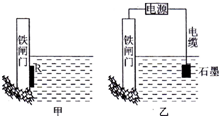 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示甲的方案,属于原电池原理(填“原电池”或“电解池”);图乙中乙方案也可降低铁闸门腐蚀速率,称为外加电流的阴极保护法保护法.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示甲的方案,属于原电池原理(填“原电池”或“电解池”);图乙中乙方案也可降低铁闸门腐蚀速率,称为外加电流的阴极保护法保护法.
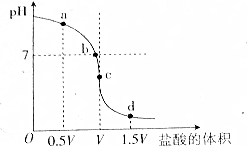 水的电离程度与溶液中所溶解的电解质有关,如图是用一定浓度的盐酸滴定V mL同浓度的NH3•H2O时得到的滴定曲线.
水的电离程度与溶液中所溶解的电解质有关,如图是用一定浓度的盐酸滴定V mL同浓度的NH3•H2O时得到的滴定曲线.