题目内容
(5分)用“>”或“<”填空:
(1)酸性:H2CO3___________H2SiO3,H2SiO3___________H3PO4。
(2)碱性:Ca(OH)2___________Ba(OH)2,Mg(OH)2___________Al(OH)3
(3)气态氢化物稳定性:NH3___________ H2O, H2S ___________ HCl
(4)还原性:HCl___________HBr,H2S___________HCl
(5)酸性:H2SO4___________H2SO3,HClO ___________ HClO4
①> < ②<>③<< ④ <> ⑤> <
解析:根据元素周期律同周期由左向右金属性逐渐减弱,非金属性逐渐增强,形成的最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强、同主族由上到下金属性逐渐增强,非金属性逐渐减弱,形成的最高价氧化物对应的水化物碱性逐渐增强,酸性逐渐减弱,氢化物越来越不稳定,C、Si,Ca、Ba分别同主族,Si、P、Al、Mg、S、Cl,N、O,分别同周期,⑴⑵⑶⑷见答案,⑸H2SO4、HClO4为强酸,H2SO3为中强酸,HClO为弱酸。

(10分) 向容积为2L的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c(B)未画出。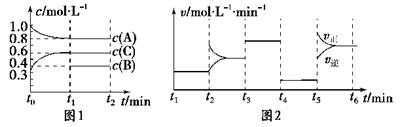
(1) 若t1=15 min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2) t4-t5阶段改变的条件为 ,B的起始物质的量为 。各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
则K1、K2、K3、K4、K5之间的关系为 (用“>”“<”或“=”连接)。
(3) 在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为 。
(9分) 向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。
一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c(B)未画出。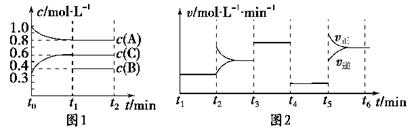
(1)若t1=15 min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=________。
(2)t4-t5阶段改变的条件为________,B的起始物质的量为________。各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:________________________。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为________。
(10分) 向容积为2L的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c(B)未画出。
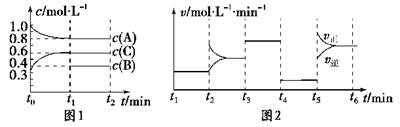
(1) 若t1=15 min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2) t4-t5阶段改变的条件为 ,B的起始物质的量为 。各阶段平衡时对应的平衡常数如下表所示:
|
t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1、K2、K3、K4、K5之间的关系为 (用“>”“<”或“=”连接)。
(3) 在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为 。
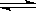 B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x的值为 __________.
B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x的值为 __________. .
. B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x 的值为 __________.
B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x 的值为 __________. .
.