题目内容
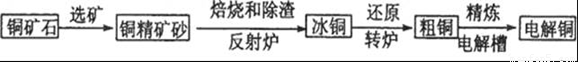
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
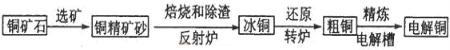
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,两种低价硫化物的化学式分别为________、_______。在反应过程中还有一部分Fe的硫化物转化为低价氧化物,其化学反应方程式为____________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量较低。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,,每有1mol氧气参加反应,生成氧化产物的物质的量为_________。生成的Cu2O与Cu2S反应,可制得含Cu量较高的粗铜。
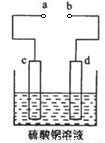
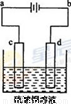
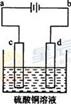
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,c为粗铜板, 则a端应连接电源的_____极(填“正”或“负”),若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有__________。
(4)可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是____________,发生反应的离子方程式为_____________,滴定时,锥形瓶中的溶液会接触空气,测得铁元素的含量会____(填“偏高”或“偏低”)。
(1)Cu2S、FeS(每空1分);2FeS+3O2 2FeO+2SO2(缺少条件的扣1分)
2FeO+2SO2(缺少条件的扣1分)
(2)2/3mol(3分,没有单位或单位错误扣1分)
(3)正(1分),Fe-2e-=Fe2+;Cu-2e-=Cu2+(4分,每个方程式2分)
(4)酸性高锰酸钾有强氧化性,能腐蚀碱式滴定管上的橡皮管(或易使橡皮管老化),所以不能用碱式滴定管盛酸性高锰酸钾溶液(必须答出两个要点:一是氧化性;二是橡皮管。缺少一个要点不得分)。
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;偏低。
【解析】
试题分析:(1)Cu的低价为+1价,Fe的低价为+2价,所以两种低价硫化物的化学式分别为Cu2S、FeS;Fe的硫化物转化为低价氧化物,FeS与O2反应生成FeO和SO2,配平可得化学方程式:2FeS+3O2 2FeO+2SO2。
2FeO+2SO2。
(2)Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2 2Cu2O+2SO2,根据化学方程式可得生成的氧化产物为SO2,物质的量为2/3mol。
2Cu2O+2SO2,根据化学方程式可得生成的氧化产物为SO2,物质的量为2/3mol。
(3)c为粗铜板,为阳极,则a端应连接电源的正极;Fe的活泼性大于Cu,所以阳极即c电极Fe和Cu失电子,发生反应的方程式为:Fe-2e-=Fe2+;Cu-2e-=Cu2+。
(4)碱式滴定管含有橡皮管,易被强氧化剂氧化而老化,酸性高锰酸钾具有强氧化性,所以不能用碱式滴定管盛酸性高锰酸钾溶液;MnO4?在酸性条件下把Fe2+氧化为Fe3+,MnO4?被还原为Mn2+,根据化合价升降法配平可得离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;滴定时,锥形瓶中的溶液会接触空气,空气中的O2能氧化Fe2+,所以酸性高锰酸钾溶液用量减少,测得铁元素的含量会偏低。
考点:本题考查化学方程式、离子方程式的书写、氧化还原反应原理、电解原理、误差分析。

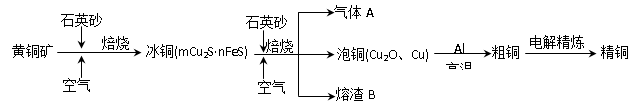
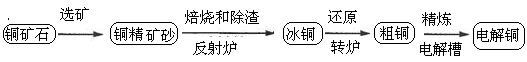


 (2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是__________、__________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是__________、__________。