题目内容
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计以下实验方案进行探究。填写下列空白。
[实验方案] 铝镁合金粉末![]() 测定剩余固体质量
测定剩余固体质量
[实验步骤]
步骤1:称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L—1NaOH溶液中,充分反应。
步骤2:过滤、洗涤、干燥、称量固体。
[交流与讨论]
(1) 实验中发生反应的化学方程式是 ;
(2)参与反应的NaOH溶液的体积V≥ ;
(3)步骤2中,如果经两次过滤滤液仍浑浊,则原因可能是_________(只填一点);
(4)步骤2中,若未洗涤固体,测得镁的质量分数将 (填“偏高”或“偏低”)。
[实验拓展] 请你另设计一个实验方案(用上述方案的试剂),测定该铝镁合金中镁的质量分数。
要求:从下图中挑选所需的仪器,画出该方案的实验装置简图(添加必要的塞子、玻璃导管、胶皮管,固定装置不用画),并标明所用试剂.

[交流与讨论](1)2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑ (2)97mL
(3)滤纸破损;过滤时漏斗里的液面高于滤纸边缘;仪器不干净等
(4)偏高
[实验拓展] 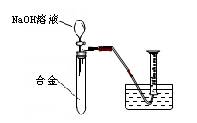
解析:
本题考查镁铝合金中镁的质量分数的测定。(1)金属铝与氢氧化钠反应生成氢气;(2)极值法考虑,设5.4g合金中含有镁的量为3%,则金属铝的物质的量为:![]() mol=0.194mol,需要氢氧化钠的物质的量为0.194mol,体积为:
mol=0.194mol,需要氢氧化钠的物质的量为0.194mol,体积为:![]() L=0.097L;(3)滤液仍浑浊,说明滤液中仍然有金属镁,过滤操作有误;(4)若没有洗涤,则镁的质量偏大,所得质量分数也偏高。
L=0.097L;(3)滤液仍浑浊,说明滤液中仍然有金属镁,过滤操作有误;(4)若没有洗涤,则镁的质量偏大,所得质量分数也偏高。

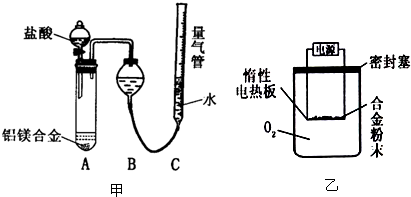
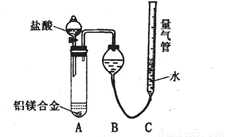
 问题讨论:
问题讨论: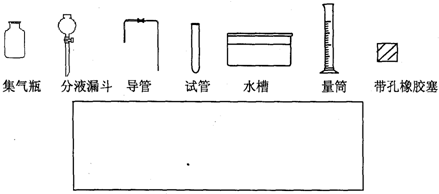
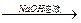 测定剩余固体质量。
测定剩余固体质量。
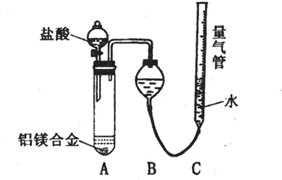
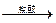 测定生成气体的体积实验装置。
测定生成气体的体积实验装置。
 测定生成气体的体积
测定生成气体的体积