题目内容
(9分)请回答下列问题:
(1)写出铜元素基态原子的电子排布式 ,属于 区
(2)写出配合物K3[Fe (SCN)6]中的中心离子为 ,配体为
(3)PCl3分子的空间构型为 ,中心原子成键时采取的杂化轨道类型为
(4)向盛有硫酸铜水溶液的试管中逐滴加入氨水至过量,实验现象是 ,有关反应的离子方程式为
(1)写出铜元素基态原子的电子排布式 ,属于 区
(2)写出配合物K3[Fe (SCN)6]中的中心离子为 ,配体为
(3)PCl3分子的空间构型为 ,中心原子成键时采取的杂化轨道类型为
(4)向盛有硫酸铜水溶液的试管中逐滴加入氨水至过量,实验现象是 ,有关反应的离子方程式为
(9分)(1)电子排布式1s22s2p63s23p63d104s1,属于 ds 区
(2) Fe3+ ,配体为 SCN - (3)空间构型为三角锥形,杂化轨道类型为sp3杂化
(4)实验现象是:先生成蓝色沉淀,继续滴加沉淀溶解,得到深蓝色的透明溶液 ,
 离子方程式为:Cu2+ + NH3·H2O=Cu(OH)2 + 2NH4+
离子方程式为:Cu2+ + NH3·H2O=Cu(OH)2 + 2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH─
(2) Fe3+ ,配体为 SCN - (3)空间构型为三角锥形,杂化轨道类型为sp3杂化
(4)实验现象是:先生成蓝色沉淀,继续滴加沉淀溶解,得到深蓝色的透明溶液 ,
 离子方程式为:Cu2+ + NH3·H2O=Cu(OH)2 + 2NH4+
离子方程式为:Cu2+ + NH3·H2O=Cu(OH)2 + 2NH4+Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH─
略

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
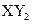 型化合物,则X与Y 的原子序数之差可能为2或5
型化合物,则X与Y 的原子序数之差可能为2或5