题目内容
将2.4mol某金属投入1.8L 2mol/L的酸中,恰好完全反应,并得到7.2gH2,则某金属的化合价为 ,该酸为 元酸.
【答案】分析:根据金属失去电子数等于酸得到的电子数相等,结合氢气的物质的量计算.
解答:解:n(H2)=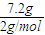 =3.6mol,
=3.6mol,
2.4mol金属共失去电子数为:3.6mol×2=7.2mol,
则1mol金属可失去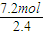 =3mol电子,
=3mol电子,
所以金属的化合价为+3价;
酸的物质的量为:1.8L×2mol/L=3.6mol,共电离产生的H+的物质的量为:n(H+)=2n(H2)=7.2mol,
则该酸为二元酸,
故答案为:+3;二.
点评:本题考查金属的化合价和酸的类型判断,题目难度不大,注意从氧化还原反应得失电子数目相等的角度解答.
解答:解:n(H2)=
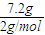 =3.6mol,
=3.6mol,2.4mol金属共失去电子数为:3.6mol×2=7.2mol,
则1mol金属可失去
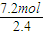 =3mol电子,
=3mol电子,所以金属的化合价为+3价;
酸的物质的量为:1.8L×2mol/L=3.6mol,共电离产生的H+的物质的量为:n(H+)=2n(H2)=7.2mol,
则该酸为二元酸,
故答案为:+3;二.
点评:本题考查金属的化合价和酸的类型判断,题目难度不大,注意从氧化还原反应得失电子数目相等的角度解答.

练习册系列答案
相关题目