题目内容
5.4.35g二氧化锰能与足量浓盐酸(密度为1.19g•cm-3、质量分数为36.5%)完全反应.求:(1)浓盐酸中HCl的物质的量浓度:c(HCl)=11.9mol/L.
(2)被氧化的HCl的物质的量:n(HCl)=0.1mol.
分析 (1)根据c=$\frac{1000ρω}{M}$计算;
(2)根据n=$\frac{m}{M}$计算二氧化锰的物质的量,根据MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O计算生成氯气的物质的量,被氧化HCl生成氯气,故被氧化的HCl的物质的量是氯气的2倍.
解答 解:(1)根据c=$\frac{1000ρω}{M}$可知,密度为1.19g•cm-3、质量分数为36.5%浓盐酸的物质的量浓度为$\frac{1000×1.19×36.5%}{36.5}$mol/L=11.9mol/L,
故答案为:11.9mol/L;
(2)4.35g二氧化锰的物质的量为$\frac{4.35g}{87g/mol}$=0.05mol,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O
1 1
0.05mol n(Cl2)
故n(Cl2)=0.05mol
被氧化的HCl生成Cl2,根据氯原子守恒可知,被氧化的HCl的物质的量是Cl2的2倍,故被氧化的HCl为0.05mol×2=0.1mol,
故答案为:0.1mol.
点评 本题考查物质的量浓度计算、氧化还原反应计算,难度不大,注意理解掌握物质的量浓度与质量分数之间关系.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
15.下列化学药品名称与警示名称对应正确的是 ( )
| A. | 浓硫酸-易爆品 | B. | 浓硝酸-放射性物品 | ||
| C. | 酒精-剧毒品 | D. | 汽油-易燃品 |
16.2011年3月11日的日本大地震造成日本福岛核电站出现严重事故,由核反应堆泄漏出的${\;}_{53}^{131}$I和罗${\;}_{55}^{137}$Cs引起了全世界的关注,其中${\;}_{55}^{137}$Cs原子核内的中子数为( )
| A. | 82 | B. | 55 | C. | 137 | D. | 192 |
20.下列实验操作中正确的是( )
| A. | 分液时,先从分液漏斗下口放出下层液体,更换烧杯后再从下口放出上层液体 | |
| B. | 蒸馏时,温度计水银球需靠近蒸馏烧瓶支管口,冷凝水的流向需从冷凝管的上进水口流入,下进水口流出 | |
| C. | 分离硝酸钾与氯化钾时,冷却结晶时析出的是溶解度随温度变化较大的固体 | |
| D. | 用托盘天平称量10.2 g固体时,如果砝码误放于左盘,固体放在右盘,则实际称得的固体质量大于10.2 g |
10.下列化学方程式中,书写完全正确的是( )
| A. | 2H2O=2H2↑+O2↑ | B. | H2SO4+NaOH=NaSO4+H2O | ||
| C. | Fe+HCI=FeCI2+H2↑ | D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 中性溶液:Fe3+、K+、Cl-、SO${\;}_{4}^{2-}$ | |
| B. | 1.0mol•L-1的FeCl3溶液:H+、S2-、Cl-、SO${\;}_{4}^{2-}$ | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生氢气的溶液:K+、Na+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ |
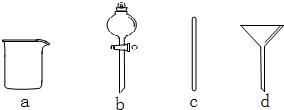 实验室需要0.1mol•L-1NaOH溶液480mL.根据溶液的配制情况回答下列问题.
实验室需要0.1mol•L-1NaOH溶液480mL.根据溶液的配制情况回答下列问题.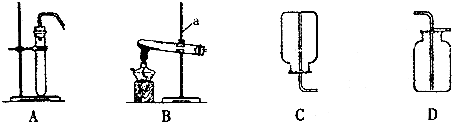
 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
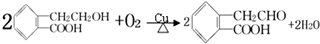

 +Br2→
+Br2→ .
.