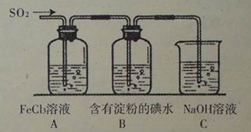
题目内容
铜与浓硫酸反应时,当转移了0.2mol电子时,消耗的硫酸有
| A.0.1mol | B.0.2mol | C.0.4mol | D.0.05mol |
B
转移了0.2mol电子时消耗的铜单质有0.1mol,根据电子守恒则产生的二氧化硫为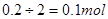 ,反应生成的硫酸铜有0.1mol,总共产物中的硫元素有0.1+0.1=0.2mol.根据硫元素守恒反应物中的硫酸有0.2mol,所以答案选B。
,反应生成的硫酸铜有0.1mol,总共产物中的硫元素有0.1+0.1=0.2mol.根据硫元素守恒反应物中的硫酸有0.2mol,所以答案选B。
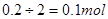 ,反应生成的硫酸铜有0.1mol,总共产物中的硫元素有0.1+0.1=0.2mol.根据硫元素守恒反应物中的硫酸有0.2mol,所以答案选B。
,反应生成的硫酸铜有0.1mol,总共产物中的硫元素有0.1+0.1=0.2mol.根据硫元素守恒反应物中的硫酸有0.2mol,所以答案选B。
练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目