题目内容
(本题共9分)化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeCl3 + Cu = 2FeCl2 + CuCl2
② Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 (填反应序号),理由是 。
(二)请根据Zn + CuSO4 = ZnSO4 + Cu反应,选择适宜的材料和试剂设计一个原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极: ;负极: 。
(一)现有如下两个反应:
① 2FeCl3 + Cu = 2FeCl2 + CuCl2
② Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 (填反应序号),理由是 。
(二)请根据Zn + CuSO4 = ZnSO4 + Cu反应,选择适宜的材料和试剂设计一个原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极: ;负极: 。
(本题共9分)
(1) ① (1分) 反应①是氧化还原反应,有电子转移。(2分,说明有电子转移给满分,只讲氧化还原反应给1分)
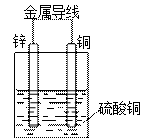 (2)
(2)
(画出图2分;标注电极全对1分,标注电解质正确1分,共4分)
②负极:Zn –2e- = Zn2+(1分) 正极:Cu2+ + 2e- =" Cu" (1分)
(1) ① (1分) 反应①是氧化还原反应,有电子转移。(2分,说明有电子转移给满分,只讲氧化还原反应给1分)
 (2)
(2)(画出图2分;标注电极全对1分,标注电解质正确1分,共4分)
②负极:Zn –2e- = Zn2+(1分) 正极:Cu2+ + 2e- =" Cu" (1分)
略

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
 C(g)
C(g) .BaCl2 + H2SO4 = BaSO4↓+ 2HCl △H < 0
.BaCl2 + H2SO4 = BaSO4↓+ 2HCl △H < 0 0
0