题目内容
【题目】从银铜合金废料中回收银并制备铜化工产品的工艺如下:
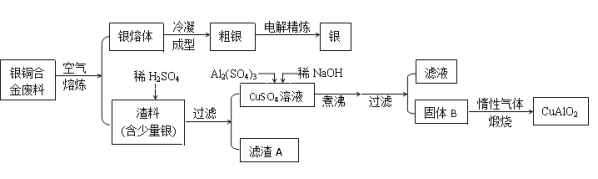
已知:①铝元素在溶液中的存在形态与溶液pH的关系如图所示。
②室温时,Cu(OH)2的溶度积Ksp=2.0×10-20,当溶液中某种离子浓度小于1.0×10-5mol/L时,认为该离子沉淀完全,![]() 。
。
③Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃。
请回答下列问题:
(1)电解精炼银时,粗银做 极(填“阴”或“阳”),电解质选用________溶液,阴极电极反应为 。
(2)在生成固体B的过程中,需控制NaOH的加入量,使溶液的pH范围在 ,若控制不当,使NaOH过量可能会引起的反应的离子方程式为 。
(3) 煅烧过程中发生多步反应,写出最终生成CuAlO2的反应的化学方程式: 。
(4)若银铜合金中铜的质量分数为64%,理论上1.0 kg废料中的铜可完全转化为CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液 L。
【答案】
(1)阳;AgNO3;Ag++e-=Ag;
(2)6.65-12;Al(OH)3+OH-=AlO2-+2H2O;
(3)2Al2O3+4CuO=4CuAlO2+O2;(4)5;
【解析】
试题分析:(1)电镀法精炼银时,粗银为阳极,精银为阴极,硝酸银作电解质溶液,阳极上失电子变成离子进入溶液了:Ag-e-=Ag+,阴极银离子得到电子形成单质银:Ag++e-=Ag,故答案为:阳;AgNO3;Ag++e-=Ag;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2,煮沸后Cu(OH)2分解产生氧化铜,可知B为Al(OH)3和CuO,在生成固体B的过程中,需控制NaOH的加入量,使溶液的pH范围在铝离子和铜离子全部沉淀,氢氧化铝沉淀完全PH=12,室温时,Cu(OH)2的溶度积Ksp=2.0×10-20.(lg5=0.7),据此计算全部沉淀的PH,c2(OH-)=![]() =2×10-15,c(H+)=10-6.65,PH=6.65,在生成固体B的过程中,需控制NaOH的加入量,使溶液的pH范围在为:6.65-12,氢氧化铝显两性能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:6.65-12; Al(OH)3+OH-=AlO2-+2H2O;
=2×10-15,c(H+)=10-6.65,PH=6.65,在生成固体B的过程中,需控制NaOH的加入量,使溶液的pH范围在为:6.65-12,氢氧化铝显两性能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:6.65-12; Al(OH)3+OH-=AlO2-+2H2O;
(3)反应前Cu为+2价,反应后为+1,化合价降低1,Al化合价没有变化,所以氧元素的化合价升高,生成氧气,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,故答案为:4CuO+2Al2O3=4CuAlO2+O2↑;
(4)由关系式:Cu~CuAlO2得n(CuAlO2)=![]() =10.0mol,则CuAlO2为10.0mol,由关系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×
=10.0mol,则CuAlO2为10.0mol,由关系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×![]() =5.0mol,所以需要体积为
=5.0mol,所以需要体积为![]() =5L,故答案为:5。
=5L,故答案为:5。

【题目】选修3——物质结构与性质
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素,相关信息如下:
X元素是宇宙中最丰富的元素 |
Y元素基态原子的核外p电子数比s电子数少1 |
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是 ,离子化合物YX5的电子式是 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐),A晶体的晶胞为正方体(如图1)。
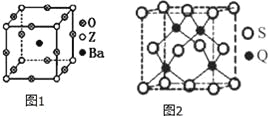
①制备A的化学反应方程式是 ;
②在A晶体中,Z的配位数为 ;
(4)R2+离子的外围电子层电子排布式为 。R2O的熔点比R2S的 (填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B,B晶体的晶胞为正方体(如图2),若晶胞棱长为5.4×10-8cm,则晶胞密度为 gcm﹣3(列式并计算)。