题目内容
|
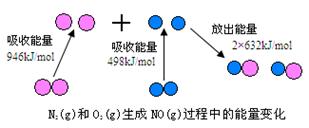
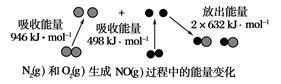
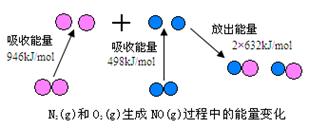
1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律.盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得.已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量.已知单质碳的燃烧热为Y kJ/mol,则1 mol C与O2反应生成CO的反应热ΔH为 | |
| [ ] | |
A. |
-Y kJ/mol |
B. |
-(5X-0.5Y) kJ/mol |
C. |
-(10X-Y) kJ/mol |
D. |
+(10X-Y) kJ/mol |
答案:B

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目