题目内容
5.100mL 2mol/L的硫酸和过量的锌反应,为了加快反应速率,但又不影响生成氢气的总量,可以采取的措施是( )| A. | 升高温度 | B. | 加入少量的Na2SO4溶液 | ||
| C. | 改用纯度高的锌粒 | D. | 改用小颗粒的锌粒 |
分析 加快反应速率,可以采用加热、增大反应物的接触面积、使其构成原电池等方法,不影响生成氢气的总量,即加入的物质不能和硫酸反应生成其它物质,据此分析解答.
解答 解:A.升高温度,活化分子百分数增大,反应速率加快,且氢离子总量不变,符合条件,故A选;
B.加入少量硫酸钠溶液,氢离子浓度降低,反应速率减慢,故B不选;
C.改用高纯度的锌粒,不能形成原电池,降低反应速率,故C不选;
D.改用小颗粒的锌粒,增大反应物接触面积,加快反应速率,且不影响氢气生成总量,故D选;
故选AD.
点评 本题考查化学反应速率影响因素,外界只是影响因素,物质性质是决定物质反应速率,从温度、浓度、催化剂等方面判断,题目难度不大.

练习册系列答案
相关题目
6.下列烷烃的一氯代物中没有同分异构体的是( )
| A. | 丁烷 | B. | 丙烷 | C. | 乙烷 | D. | 2-甲基丙烷 |
7.下列表示丙基的是( )
| A. | CH3CH2CH3 | B. | CH3CH2CH2- | C. | -CH2CH2- | D. | CH3- |
13.分子式为C5H12的烷烃的一氯取代物共有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
20.下列各物质中,最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 丙烯和环己烷 | B. | 乙烯和己烯 | C. | 乙烷和苯 | D. | 正丁烷和异丁烷 |
10.下列叙述正确的是( )
| A. | 聚丙烯的结构简式为: | B. | 氯化氢的电子式为: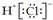 | ||
| C. | 甲烷的比例模型: | D. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl |
17.Cyrneine A对治疗神经系统疾病有着很好的疗效.可用香芹酮经过多步反应合成:

下列说法正确的是( )

下列说法正确的是( )
| A. | 香芹酮化学式为C9H12O | |
| B. | Cyrneine A可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色 | |
| D. | 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 |
14.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: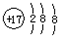 | B. | 氯化铵的电子式: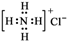 | ||
| C. | CO2的结构式:O=C=O | D. | CH4的比例模型: |
15.下列物质既能与强酸又能够与强碱反应,且反应后都能产生气体的是( )
| A. | 碳酸氢铵 | B. | 亚硫酸氢钾 | C. | 碳酸氢钠 | D. | 硫酸氢铵 |