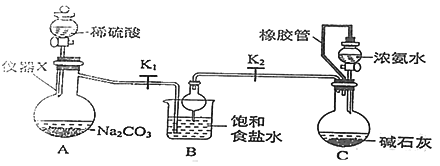
题目内容
【题目】(1)标准状况下11.2L,由CO和H2组成的混合气体的质量为7.2g,则混合气体的平均摩尔质量为___;此混合气体完全燃烧,将燃烧产物通过足量过氧化钠后,固体增重___g。
(2)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是___。(填序号)
【答案】14.4g/mol 7.2 ②
【解析】
⑴标准状况下11.2L即物质的量为0.5mol,由CO和H2组成的混合气体的质量为7.2g,则混合气体的平均摩尔质量为![]() ,此混合气体完全燃烧,将燃烧产物二氧化碳和水,产物通过足量过氧化钠生成碳酸钠和氢氧化钠,能写成(CO)m(H2)n的气体混合物,充分燃烧产物通入到过氧化钠中,质量增重7.2g,故答案为:14.4g/mol;7.2。
,此混合气体完全燃烧,将燃烧产物二氧化碳和水,产物通过足量过氧化钠生成碳酸钠和氢氧化钠,能写成(CO)m(H2)n的气体混合物,充分燃烧产物通入到过氧化钠中,质量增重7.2g,故答案为:14.4g/mol;7.2。
⑵若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,高锰酸钾从+7价降到+2价,降低5个价态,1mol高锰酸钾能得到2.5mol氯气,二氧化锰由+4价降低到+2价,1mol二氧化锰能得到1mol氯气,次氯酸钙由+1价降低到0价,有2mol氯降低,且有2mol氯由-1价升高到0价,1mol次氯酸钙最终得到2mol氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是②,故答案为:②。

【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.已知某些化学键的键能数据如下
化学键 | C=O | C—O | C—H | H—H | O—H |
键能/kJ·mol-1 | 745 | 351 | 415 | 436 | 462 |
则CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH = __________ kJ·mol-1
CH3OH(g) + H2O(g) ΔH = __________ kJ·mol-1
II.将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(l)
CH3OCH3(g) + 3H2O(l)
(1)该反应化学平衡常数表达式K = __________。
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图所示:

①该反应的ΔH __________ 0(填“>"或“<”)。
②若温度不变,减小反应投料比[n(H2)/n(CO2)],K值将____(填“增大”、“减小”或“不变”)。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是__________。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0 mol CO2 6.0 mol H2 | 0.10 mol | 0.04 mol | 0.02 mol |
II.1.0 mol CO22 | X1 | Y1 | Z1 |
III.1.0 mol CH3OCH3 3.0 mol H2O | X2 | Y2 | Z2 |
①P1 __________ P3(填“>”“<”或“=”);
②P2下,III中CH3OCH3的平衡转化率为__________。