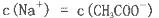题目内容
下列溶液中各离子的浓度关系不正确的是( )
c(Na+)>c(CO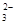 )>c(HCO
)>c(HCO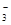 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
| A.0.1 mol·L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1 |
| B.浓度均为0.1 mol·L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中: c(CO 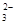 )+c(OH-)=c(H+)+c(H2CO3) )+c(OH-)=c(H+)+c(H2CO3) |
| C.25 ℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中: c(Na+>c(CN-)>c(HCN)>c(OH-) |
| D. 3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中: |
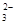 )>c(HCO
)>c(HCO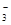 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)CD
试题分析:A、物料守恒,正确;B、混合得到NaHCO3,质子守恒,正确;C、此混合溶液中存在HCN电离平衡和NaCN水解平衡,溶液为碱性,以水解平衡为主,故c(HCN)>c(Na+>c(CN-)> c(OH-),错误;
D、0.3mol NaOH通入0.2mol CO2,产物为同浓度的Na2CO3和NaHCO3,其中存在水解和电离平衡,其中以Na2CO3第一步水解为主,故有c(Na+)> c(HCO
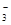 )>c(CO
)>c(CO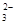 )> c(OH-)>c(H+),错误。
)> c(OH-)>c(H+),错误。
练习册系列答案
相关题目