题目内容
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高,其主要流程如下:

注:反应II的离子方程式为Cu2+ +CuS+4Cl- ═2[CuCl2]-+S↓
请回答下列问题;
(1)反应I的产物为 (填化学式)。
(2)反应Ⅲ的离子方程式为 。
(3)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是 。
(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均成酸性,相同条件下,同浓度的两种水溶液c(SO32-)较小的是 。
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3 溶液完全反应后,用浓度为0.02000mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00Ml。 已知:Cr2O72- +Fe2+ +H+→Cr3+ +Fe3+ +H2O(未配平)反应IV所得气体中SO2的体积分数为 。
【答案】(10分)
(1)FeS2、CuS
(2)4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O
(3)该温度下,硫酸铜的溶解度小于氯化铜、加入硫酸,有利于析出硫酸铜晶体
(4)NH4HSO3;
(5)12.00%
【解析】
试题分析:铜矿与S在高温下煅烧,使其转变为FeS2、CuS,加入HCl、NaCl、CuCl2混合溶液 发生反应Cu2++CuS+4Cl-=2[CuCl2]-+S↓,过滤得到滤液中通入空气发生反应4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O,一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,结晶分离得到硫酸铜晶体,加入铁还原溶液得到铜;滤渣分离得到FeS和S,FeS2通入空气灼烧得到氧化铁和二氧化硫,氧化铁炼钢,二氧化硫制备硫酸。
(1)由流程可知,黄铁矿分解生成的Fe、Cu均为+2价,则反应I的产物为FeS2、CuS;
(2)反应Ⅲ中生成铜离子,则离子反应为4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O;
(3)相同条件下硫酸铜的溶解度小,则该温度下,硫酸铜的溶解度小于氯化铜,所以向反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体;
(4)NH4HSO3与NaHSO3溶液中都发生HSO3的水解反应:HSO3-![]() H+ +SO32-,NH4HSO3中NH4+水解:NH4++H2O
H+ +SO32-,NH4HSO3中NH4+水解:NH4++H2O![]() NH3H2O+H+,c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小,所以NH4HSO3溶液中c(SO32-)较小。
NH3H2O+H+,c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小,所以NH4HSO3溶液中c(SO32-)较小。
(5)利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,
可知,3SO2~Cr2O72-,
3 1
x 0.02mol/L×0.025L
解得x=0.0015mol,反应Ⅳ所得气体中SO2的体积分数为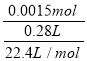 ×100%=12.00%。
×100%=12.00%。

 通城学典默写能手系列答案
通城学典默写能手系列答案


