题目内容
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、16 g甲烷分子中含有共价键的数目为2NA |
| B、常温常压下,30g葡萄糖含有的氧原子数为NA |
| C、0.1mol/L的AlCl3溶液中含有的氯离子数为0.3NA |
| D、25℃时,1L 0.1mol/L的CH3COOH溶液中的H+数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.甲烷分子中含有4个碳氢共价键,16g甲烷的物质的量为1mol,含有4mol碳氢键;
B.葡萄糖的摩尔质量为180g/mol,葡萄糖的分子式为C6H12O6,据此计算出30个葡萄糖中含有的氧原子数目;
C.缺少氯化铝溶液的体积,无法计算溶液中氯离子的数目;
D.醋酸为弱电解质,溶液中只能部分电离出氢离子.
B.葡萄糖的摩尔质量为180g/mol,葡萄糖的分子式为C6H12O6,据此计算出30个葡萄糖中含有的氧原子数目;
C.缺少氯化铝溶液的体积,无法计算溶液中氯离子的数目;
D.醋酸为弱电解质,溶液中只能部分电离出氢离子.
解答:
解:A.甲烷的电子式为 ,分子中含4个碳氢共价键,16g甲烷的物质的量为1mol,1mol甲烷中含有4mol碳氢共价键,含有共价键的数目为4NA,故A错误;
,分子中含4个碳氢共价键,16g甲烷的物质的量为1mol,1mol甲烷中含有4mol碳氢共价键,含有共价键的数目为4NA,故A错误;
B.30g葡萄糖的物质的量为:
=
mol,葡萄糖的分子式为C6H12O6,
mol葡萄糖分子中含有氧原子的物质的量为:
mol×6=1mol,所以30g葡萄糖含有的氧原子数为NA,故B正确;
C.没有告诉0.1mol/L的AlCl3溶液的体积,无法计算溶液中氯离子的物质的量及数目,故C错误;
D.1L 0.1mol/L的CH3COOH溶液中含有溶质醋酸0.1mol/L×1L=0.1mol,由于醋酸为弱酸,所以0.1mol醋酸电离出的氢离子小于0.1mol,溶液中的H+数小于0.1NA,故D错误;
故选B.
 ,分子中含4个碳氢共价键,16g甲烷的物质的量为1mol,1mol甲烷中含有4mol碳氢共价键,含有共价键的数目为4NA,故A错误;
,分子中含4个碳氢共价键,16g甲烷的物质的量为1mol,1mol甲烷中含有4mol碳氢共价键,含有共价键的数目为4NA,故A错误;B.30g葡萄糖的物质的量为:
| 30g |
| 180g/mol |
| 1 |
| 6 |
| 1 |
| 6 |
| 1 |
| 6 |
C.没有告诉0.1mol/L的AlCl3溶液的体积,无法计算溶液中氯离子的物质的量及数目,故C错误;
D.1L 0.1mol/L的CH3COOH溶液中含有溶质醋酸0.1mol/L×1L=0.1mol,由于醋酸为弱酸,所以0.1mol醋酸电离出的氢离子小于0.1mol,溶液中的H+数小于0.1NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项C为易错点,注意题中缺少溶液的体积,无法计算氯离子的物质的量.

练习册系列答案
相关题目
 用如图表示的一些物质或概念之间的从属或包含关系中不正确的是( )
用如图表示的一些物质或概念之间的从属或包含关系中不正确的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 含氧酸 | 酸 | 化合物 |
| B | 溶液 | 分散系 | 混合物 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 单质 | 化合物 | 纯净物 |
| A、A | B、B | C、C | D、D |
由乙炔(C2H2)、苯(C6H6)、苯乙烯(C8H8)和乙醛(CH3CHO)组成的混合物中碳的质量分数为60%,则氢的质量分数为( )
| A、5% | B、8.9% |
| C、17.8% | D、无法确定 |
下列各反应的能量变化分别用如下形式的示意图表示,其中正确的是( )
A、 化石燃料的燃烧 |
B、 植物的光合作用 |
C、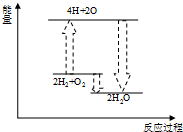 氢气与氧气反应 |
D、 氢气与氯气反应 |
海洋中有丰富的食品、矿产、能源、药物和水产资源,对今后世界经济发展有着决定性作用.下列有关说法正确的是( )


| A、整个过程可在实验室中模拟进行 |
| B、工段②是风化过程 |
| C、在工段③④⑤中溴元素均被氧化 |
| D、工段①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
下列离子方程式书写正确的是( )
| A、NH4Cl溶液与苏打溶液混合:2NH4++CO32-═2NH3↑+CO2↑+H2O | ||||
| B、向Mg(OH)2沉淀中加入FeCl3溶液:3Mg(OH)2+2Fe3+═3Mg2++2Fe(OH)3 | ||||
C、用石墨作电极电解AlCl3溶液:2Cl-+2H2O
| ||||
| D、FeCl3溶液与Na2SO3溶液混合:2Fe3++3SO32-+3H2O═2Fe(OH)3↓+3SO2↑ |
将苯分子中的一个碳原子换成一个氮原子,得到一种类似苯环结构的稳定有机物,该有机物的一氯代物有几种( )
| A、1 | B、3 | C、4 | D、5 |
同位素在化学反应机理的研究中有着重要的作用.下列有关乙酸乙酯水解的化学方程式不正确的是( )
| A、CH3COOCH2CH3+HOD→CH3COOD+CH3CH2OH |
| B、CH3COOCH2CH3+HOD→CH3COOH+CH3CH2OD |
| C、CH3CO18OCH2CH3+H2O→CH3CO18OH+CH3CH2OH |
| D、CH3C18OOC H2CH3+H2O→CH3C18OOH+CH3CH2OH |
 某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.
某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.