题目内容
14.在饱和的氯水中还可以大量存在的离子是( )| A. | I- | B. | HCO3- | C. | SO42- | D. | Fe2+ |
分析 饱和氯水具有酸性和强氧化性,能够与HCO3-反应,能氧化碘离子和二价铁,据此分析解答.
解答 解:A.饱和氯水具有强氧化性,能氧化碘离子生成碘单质,故A错误;
B.饱和氯水具有酸性,能够与HCO3-反应生成二氧化碳和水,故B错误;
C.饱和氯水与SO42-不反应,可以大量存在,故C正确;
D.饱和氯水具有强氧化性,能氧化二价铁生成三价铁离子,故D错误;
故选C.
点评 本题考查了氯水的性质以及离子间的反应,难度不大,注意氧化还原反应的发生.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
3.由羟基与下列基团组成的化合物中,属于醇类的是( )
| A. | NH2- | B. |  | C. | 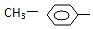 | D. | R-CO- |
5.下列说法正确的是( )
| A. | 25℃时,pH=2的硫酸与pH=12的Na0H溶液等体积混合溶液显酸性 | |
| B. | 20mL0.1mol/L二元弱酸H2A溶液与等体积,等浓度的NaOH溶液混合后,混合溶液中c(Na+)=c(H2A)+c(HA-)+c(A2-)=0.1mol/L | |
| C. | 向Na2CO3溶被中通入CO2至溶液为中性,则$\frac{{c(N{a^+})}}{{c(C{O_3}^{2-})}}$>1 | |
| D. | 常温下,向含0.lmolCH3COOH的溶液中加入amolNaOH 固体,反应后溶液中c(CH3COOH)=c(CH3COO-),则溶液显碱性.(已知醋酸的电离常数Ka=1.75×10-5) |
2.下列物质中,可用于制作太阳能电池的是( )
| A. | Si | B. | SiO2 | C. | H2SiO3 | D. | Na2SiO3 |
9.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,则下列有关说法中,不正确的是( )
| A. | 1 mol NH 5 中含有5N A 个NH键(N A 表示阿伏加德罗常数) | |
| B. | NH 5 中既有共价键又有离子键,它形成的晶体是离子晶体 | |
| C. | NH 5的电子式为: | |
| D. | 它与水反应的化学方程式为:NH 5+H 2O═NH 3H 2O+H 2↑ |
19.下列说法正确的是( )
| A. |  的名称应为2-甲基-2-丙醇 的名称应为2-甲基-2-丙醇 | |
| B. | 2-甲基-3,6-己二醇根据羟基数目分类应属于二元醇 | |
| C. |  的名称为4-甲基-3,4-己二醇 的名称为4-甲基-3,4-己二醇 | |
| D. | 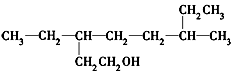 的名称为3,6-二乙基-1-庚醇 的名称为3,6-二乙基-1-庚醇 |
6.下列各原子或离子的电子排布式错误的是( )
| A. | K+ 1s22s22p63s23p6 | B. | Cu+ 1s22s22p63s23p63d104s1 | ||
| C. | N3- 1s22s22p6 | D. | As 1s22s22p63s23p63d104s24p3 |
1.化学与生产、生活密切相关.下列说法正确的是( )
| A. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| B. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧,说明“纳米铜”的还原性比铜片更强 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
 取一定量的铁粉与2mol•L-1稀硝酸400mL反应,反应后硝酸和铁均无剩余(铁只显+2价),且硝酸的还原产物只有NO.(不考虑溶液体积的变化)
取一定量的铁粉与2mol•L-1稀硝酸400mL反应,反应后硝酸和铁均无剩余(铁只显+2价),且硝酸的还原产物只有NO.(不考虑溶液体积的变化)