题目内容
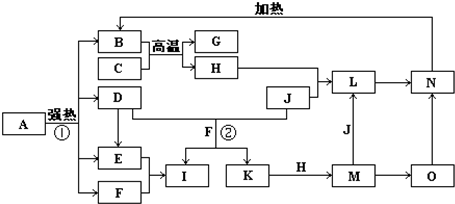
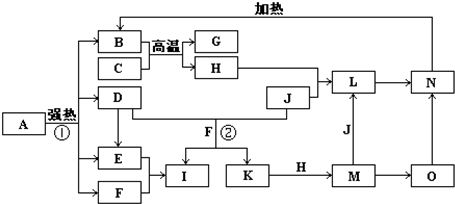
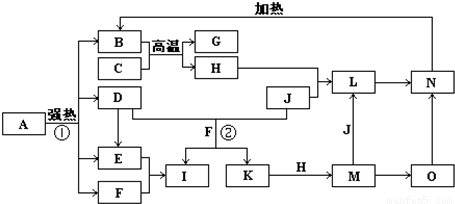
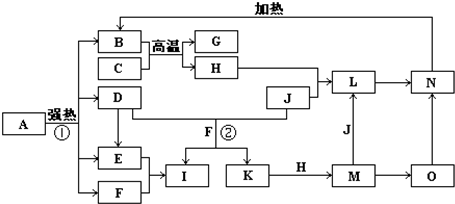
如图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质.O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品(图中部分反应物和生成物没有列出).
请按要求回答:
(1)写出G、L的化学式G:
(2)反应②的离子方程式
(3)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1:1:1:14,则该反应的化学方程式为
(4)将A直接溶于水(未加稀硫酸酸化)得到的溶液,敞口久置,变质过程中涉及的离子方程式为

请按要求回答:
(1)写出G、L的化学式G:
Al2O3
Al2O3
,L:FeCl3
FeCl3
.(2)反应②的离子方程式
SO2+Cl2+2H2O=4H++SO42-+2Cl-
SO2+Cl2+2H2O=4H++SO42-+2Cl-
.(3)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1:1:1:14,则该反应的化学方程式为
2FeSO4?7H2O
Fe2O3+SO2↑+SO3↑+14H2O
| ||
2FeSO4?7H2O
Fe2O3+SO2↑+SO3↑+14H2O
.
| ||
(4)将A直接溶于水(未加稀硫酸酸化)得到的溶液,敞口久置,变质过程中涉及的离子方程式为
12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓
12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓
.分析:本题考查学生对元素化合物知识的掌握情况,解题第一突破口:C、H是日常生活中最常见的单质,且相互间能发生置换反应:“C+B
G+H”,可联系铝热反应进行分析得H为铁,再据H+J→L、M+J→L,可进一步确认C为Al,H为Fe,G是Al2O3,M含Fe2+,L含Fe3+,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M和J反应生成L,所以L为FeCl3,M为FeCl2,判断K为HCl,依据转化关系中的反应,D+J(Cl2)+F(H2O)=I(H2SO4)+K(HCl),推断D为SO2;
第二突破口:I是基础化学工业的重要产品,其消费量常被视为一个国家工业发达水平的一种标志,则I是H2SO4,E为SO3,F为H2O,依据判断出的各物质进行分析回答.
| 高温 |
第二突破口:I是基础化学工业的重要产品,其消费量常被视为一个国家工业发达水平的一种标志,则I是H2SO4,E为SO3,F为H2O,依据判断出的各物质进行分析回答.
解答:解:C、H是日常生活中最常见的单质,且相互间能发生置换反应:“C+B
G+H”,可联系铝热反应进行分析得H为铁,再据H+J→L、M+J→L,可进一步确认C为Al,H为Fe,G是Al2O3,M含Fe2+,L含Fe3+,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M和J反应生成L,所以L为FeCl3,M为FeCl2,判断K为HCl,依据转化关系中的反应,D+J(Cl2)+F(H2O)=I(H2SO4)+K(HCl),推断D为SO2;I是基础化学工业的重要产品,其消费量常被视为一个国家工业发达水平的一种标志,则I是H2SO4,E为SO3,F为H2O,
(1)由以上分析可知G为Al2O3,L为FeCl3,故答案为:Al2O3;FeCl3;
(2)反应②是二氧化硫和氯气在水溶液中反应,离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
(3)反应①是分解反应,反应中生成的B(Fe2O3)、D(SO2)、E(SO3)、F(H2O)的物质的量之比为1:1:1:14,依据反应前后原子守恒可以推断出A的化学式,为FeSO4?7H2O,配平化学方程式得到:2(FeSO4?7H2O)
Fe2O3+SO2↑+SO3↑+14H2O,
故答案为:2FeSO4?7H2O
Fe2O3+SO2↑+SO3↑+14H2O;
(4)A为FeSO4?7H2O,具有还原性,易被空气中氧气氧化为Fe3+,敞口久置,Fe3+水解生成Fe(OH)3,反应的离子方程式为12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓,
故答案为:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓.
| 高温 |
(1)由以上分析可知G为Al2O3,L为FeCl3,故答案为:Al2O3;FeCl3;
(2)反应②是二氧化硫和氯气在水溶液中反应,离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
(3)反应①是分解反应,反应中生成的B(Fe2O3)、D(SO2)、E(SO3)、F(H2O)的物质的量之比为1:1:1:14,依据反应前后原子守恒可以推断出A的化学式,为FeSO4?7H2O,配平化学方程式得到:2(FeSO4?7H2O)
| ||
故答案为:2FeSO4?7H2O
| ||
(4)A为FeSO4?7H2O,具有还原性,易被空气中氧气氧化为Fe3+,敞口久置,Fe3+水解生成Fe(OH)3,反应的离子方程式为12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓,
故答案为:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓.
点评:本题考查了物质转化关系和物质性质的综合应用,主要考查了常见金属及其化合物的性质应用,铝热反应应用,铁及其化合物的性质应用,二氧化硫,三氧化硫的性质应用,化学式的金属判断,题目难度较大,需要熟悉物质性质的特征反应,转化关系的分析判断.

练习册系列答案
相关题目