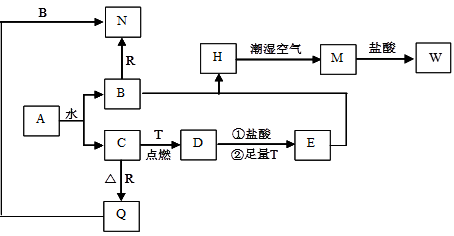
题目内容
铁屑可用于地下水脱氮,其实验室研究步骤如下:
Ⅰ、将铁屑浸泡在0.5 mol/L盐酸中进行预处理。
Ⅱ、30 min后,用去离子水反复冲洗,至冲洗后液体的pH为中性。在N2保护下烘干备用。
Ⅲ、在蒸馏水中加入硝酸钾配制硝酸钾溶液。
Ⅳ、将酸预处理后的铁屑加入硝酸钾溶液中。
请回答:
(1)盐酸溶解Fe2O3的离子方程式是 。
(2)烘干时需要在N2保护下进行的原因是 。
(3)将步骤Ⅱ中冲洗后的溶液在空气中加热蒸发灼烧,最终得到的固体是 。
(4)将酸性条件下,铁与NO3-反应的离子方程式补充完整: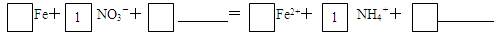
(5)已知活性炭能吸附NH4+ 、OH-。步骤Ⅳ中操作时将铁屑和活性炭同时加入硝酸钾溶液中,可以提高脱氮的效果,其原因是 。
(6)研究表明溶液pH会影响铁屑脱氮的效果,反应体系的pH分别控制在4 和8. 5 时,NO3-的去除率分别为90% 和15%。正常地下水中含有CO32-,会影响脱氮的效果,用化学用语和文字简述其原因 。
(1)Fe2O3+ 6H+= 2Fe3+ +3H2O (2)防止铁屑在空气中被氧化 (3)Fe2O3
(4)4 Fe + NO3-+ 10H+=4 Fe2+ + NH4+ +3H2O
(5)活性炭的添加使其和铁构成了无数个微小的铁碳原电池加快反应速率,其次活性炭吸附生成物NH4+ 、OH-能降低出水中的NH4+的浓度。(并且能降低出水pH 值,这可能是因为活性炭能够吸附OH-。)
(6)CO32-+H2O  HCO3-+ OH-增大了溶液的pH会降低脱氮效果;Fe2+ + CO32-= FeCO3↓覆盖在反应物的表面阻止反应进行。
HCO3-+ OH-增大了溶液的pH会降低脱氮效果;Fe2+ + CO32-= FeCO3↓覆盖在反应物的表面阻止反应进行。
解析试题分析:(1)盐酸能与金属氧化物发生反应得到可溶性盐酸盐和水,HCl溶解Fe2O3的离子方程式是Fe2O3+ 6H+= 2Fe3+ +3H2O。(2)烘干时需要在N2保护下进行否则铁屑在空气中被氧化。(3)将步骤Ⅱ中冲洗后的溶液为FeCl2,它是强酸弱碱盐,在溶液中会发生水解反应FeCl2+2H2O Fe(OH)2+2HCl,随着不断加热,水分蒸发。促进盐的水解,由于HCl有挥发性会逸出,所以得到固体Fe(OH)2。而Fe(OH)2不稳定,会被空气中的氧气氧化为Fe(OH)3.在空气中加热灼烧,发生分解反应2Fe(OH)3
Fe(OH)2+2HCl,随着不断加热,水分蒸发。促进盐的水解,由于HCl有挥发性会逸出,所以得到固体Fe(OH)2。而Fe(OH)2不稳定,会被空气中的氧气氧化为Fe(OH)3.在空气中加热灼烧,发生分解反应2Fe(OH)3 Fe2O3+3H2O.因此最终得到的固体是Fe2O3。(4)根据电子守恒、电荷守恒及原子守恒可得将酸性条件下,铁与NO3-反应的离子方程式为:4 Fe + NO3-+ 10H+=4 Fe2+ + NH4+ +3H2O。(5)添加活性炭后,在溶液中C与铁构成了无数个微小的铁碳原电池加快反应速率;此外活性炭吸附生成物NH4+ 、OH-能降低出水中的NH4+的浓度及降低水溶液的pH 值。(6)在正常地下水中含有CO32-。它会发生水解反应: CO32- +H2O
Fe2O3+3H2O.因此最终得到的固体是Fe2O3。(4)根据电子守恒、电荷守恒及原子守恒可得将酸性条件下,铁与NO3-反应的离子方程式为:4 Fe + NO3-+ 10H+=4 Fe2+ + NH4+ +3H2O。(5)添加活性炭后,在溶液中C与铁构成了无数个微小的铁碳原电池加快反应速率;此外活性炭吸附生成物NH4+ 、OH-能降低出水中的NH4+的浓度及降低水溶液的pH 值。(6)在正常地下水中含有CO32-。它会发生水解反应: CO32- +H2O OH-+HCO3-,使溶液显碱性,溶液的pH的增大会降低脱氮效果;此外还会发生沉淀反应:Fe2+ + CO32-= FeCO3↓覆盖在反应物的表面阻止反应进行。
OH-+HCO3-,使溶液显碱性,溶液的pH的增大会降低脱氮效果;此外还会发生沉淀反应:Fe2+ + CO32-= FeCO3↓覆盖在反应物的表面阻止反应进行。
考点:考查铁屑在地下水脱氮中的应用的知识。

 名师指导期末冲刺卷系列答案
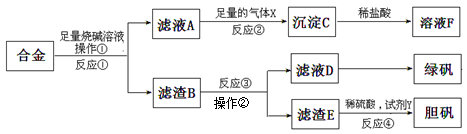
名师指导期末冲刺卷系列答案(16分)钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸和制备氧化铁涂料。 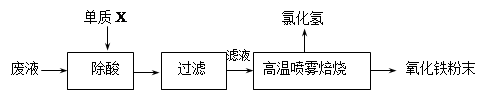
(1)单质X的化学式是 。
(2)氯化亚铁溶液经高温喷雾焙烧转化为HCl气体和氧化铁粉末,有关的化学方程式依次为: 。
(3)某铁红涂料中除含有Fe2O3外,还可能添加有CuO或FeO中的一种,请设计实验方案,探究该铁红涂料中添加物的成分。
① 提出合理假设
假设1:添加了CuO
假设2:添加了FeO
② 请设计方案,验证上述假设,写出实验步骤、预期现象和结论。
限选试剂:铁粉、3mol?L-1H2SO4、0.1 mol?L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管中, ____________________________________________ | 样品全部溶解,得到澄清的溶液。 |
| 步骤2. 步骤3. | ___________________________ ___________________________ |
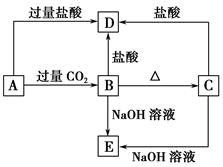
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。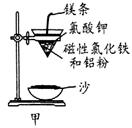


(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
(3)为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。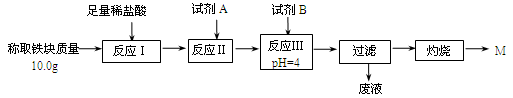
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
② 已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③ 灼烧完全的标志是 。
④ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。
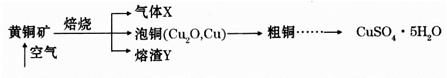
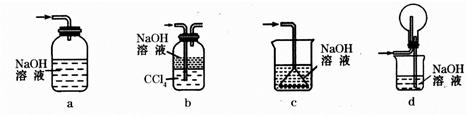

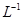 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:
滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: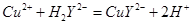 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。