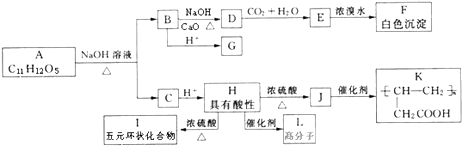
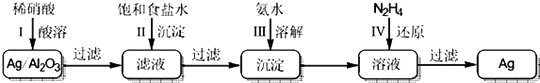
题目内容
【题目】有铁和锌的混合物共9.3g,与500mL盐酸恰好完全反应,在标准状况下共收集到3.36LH2 , 求:
(1)铁的质量是g;
(2)反应前,盐酸的物质的量浓度为mol/L;
(3)写出锌与盐酸反应的离子方程式并用双线桥表示电子转移.
【答案】
(1)2.8
(2)0.6
(3)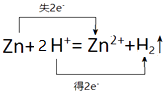
【解析】解:(1)令铁和锌的物质的量分别为amol、bmol,则:
Fe~~ | H2 | Zn~~ | H2 |
amol | amol | bmol | bmol |
所以 ![]()
解得:a=0.05,b=0.1
故混合物铁的质量为0.05mol×56g/mol=2.8g,
所以答案是:2.8;
(2)标准状况下3.36L H2的物质的量为 ![]() =0.15mol,所以根据H元素守恒,则HCl的物质的量为0.15mol×2=0.3mol,所以c=
=0.15mol,所以根据H元素守恒,则HCl的物质的量为0.15mol×2=0.3mol,所以c= ![]() =
= ![]() =0.6mol/L;
=0.6mol/L;
所以答案是:0.6;
(3)锌与盐酸反应生成锌离子和氢气,其中锌失电子,氢离子得电子,转移电子数为2e﹣,所以用双线桥表示电子转移为:
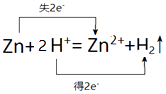 ,
,
所以答案是: 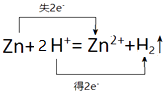 .
.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目