题目内容
根据下图所示的装置回答下列问题:(1)铁片与铜片不用导线连接,有何现象发生?写出反应的化学方程式。_____________________________________________________________________
(2)用导线把金属片连接起来,现象有什么不同?用最恰当的化学方程式表示发生的反应。_____________________________________________________________________

解析:第(1)种情况,铜片不起作用,铁与H+反应,但速率较小,铁片越纯,表面越光滑,反应速率越小。第(2)种情况,用导线连接后构成了原电池,正极产生氢气,所以气泡从铜片表面逸出。原电池的形成使电子得以顺利转移,H+在Cu表面得到电子比在铁表面容易得多,所以反应速率增大,氢气逸出速率增大,铁的溶解速率也增大。
答案:(1)铁片与铜片不用导线连接,则铁片表面有气泡产生,但速率较慢。
Fe+H2SO4![]() FeSO4+H2↑
FeSO4+H2↑
(2)①气泡不从铁片表面而是从铜片表面逸出;②产生氢气的速率明显加大。电极反应式:
负极:Fe-2e-![]() Fe2+
Fe2+
正极:2H++2e-![]() H2↑
H2↑

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
由化学能转变的热能或电能仍然是人类使用的主要能源。根据下图所示的装置,判断下列说法不正确的是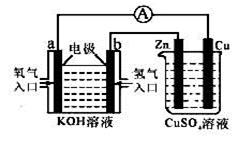
| A.该装置中铜为阳极 |
| B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L |
| C.该装置中b极的电极反应式是:H2+2OH--2e-== 2H2O |
| D.该装置中a极为正极,发生氧化反应 |
由化学能转变的热能或电能仍然是人类使用的主要能源。根据下图所示的装置,判断下列说法不正确的是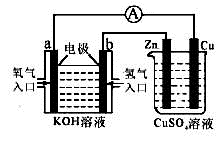
| A.该装置中Cu极为阳极 |
| B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L |
| C.该装置中b极的电极反应式是:H2+2OH--2e-===2H2O |
| D.该装置中a极为正极,发生氧化反应 |

