题目内容
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
| A.8.4 L | B.13.5 L | C.10.7 L | D.16.8 L |
B
解析试题分析:1 mol CuS与HNO3失8 mol e-,1 mol Cu2S与HNO3失10 mol e-。若混合物中仅含有CuS,反应失电子 ×8="1.2" mol;若原混合物中仅含有Cu2S,反应失电子
×8="1.2" mol;若原混合物中仅含有Cu2S,反应失电子 ×10="1.5" mol,则混合物在反应中失去电子数1.2 mol< n(e-)<1.5 mol。而生成1 mol混合气体得到电子数为(5-4)×
×10="1.5" mol,则混合物在反应中失去电子数1.2 mol< n(e-)<1.5 mol。而生成1 mol混合气体得到电子数为(5-4)× +(5-2)×
+(5-2)× ="2" mol,由电子守恒可知,生成气体的的体积
="2" mol,由电子守恒可知,生成气体的的体积 ×22.4 L < V <
×22.4 L < V < 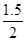 ×22.4 L,即13.44L<V<16.8L,B项正确。
×22.4 L,即13.44L<V<16.8L,B项正确。
考点:氧化还原反应

金属钾的冶炼可采用如下方法:2KF+CaC2 CaF2+2K↑+2C,下列有关说法合理的是( )
CaF2+2K↑+2C,下列有关说法合理的是( )
| A.该反应的氧化剂是KF,氧化产物是K |
| B.该反应能说明C的还原性大于K |
| C.电解KF溶液不可能制备金属钾 |
| D.CaC2、CaF2均为离子化合物,且阴、阳离子个数比均为2∶1 |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用相同的是( )
| A.2Na + 2H2O=2NaOH + H2↑ |
| B.2F2+2H2O=4HF+O2 |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
下列有关说法错误的是( )
| A.H2O2、Na2O2都属于过氧化物、都存在非极性共价键 |
| B.H2O2做漂白剂是利用其强氧化性,漂白原理与HClO类似但与SO2不同 |
| C.双氧水是绿色氧化剂,可作医疗消毒剂 |
| D.H2O2既有氧化性又有还原性,1molH2O2在参加反应时一定转移2mol电子 |
已知NH4CuSO3与足量的10 mol/L硫酸混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸作氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.1 mol NH4CuSO3完全反应转移0.5 mol电子 |
在100mL含等物质的量的HI和H2SO3的溶液里通入0.14molCl2,有三分之一的HI变为I2(已知:I2+H2SO3+H2O=4H++SO42—+2I—)。原溶液中HI和H2SO3的浓度都等于
| A.8.0 mol?L-1 | B.0.12 mol?L-1 |
| C.0. 8 mol?L-1 | D.1.2 mol?L-1 |
下列反应进行分类时,既属于氧化还原反应又属于置换反应的是
| A.Zn+H2SO4=ZnSO4+H2↑ | B.2KClO3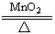 2KCl+3O2↑ 2KCl+3O2↑ |
C.S+O2 SO2 SO2 | D.CH4+2O2 CO2+2H2O CO2+2H2O |
下列反应都有水参加,其中属于氧化还原反应,而水既不做氧化剂,又不做还原剂的是
| A.2F2+2H2O=4HF+O2 | B.2Na+2H2O=2NaOH+H2↑ |
| C.C12+H2O=HC1O+HC1 | D.C+H2O CO+H2 CO+H2 |
成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
| A.木已成舟 | B.铁杵成针 | C.蜡炬成灰 | D.滴水成冰 |