题目内容
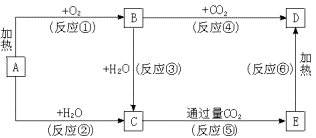
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.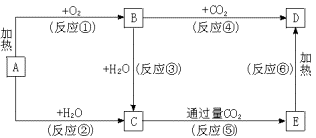
请填写下列空白:
(1)写出化学式:A________________,B________________,D________________.
(2)以上反应中,属于氧化还原反应的有____________________(填写编号).
(3)写出E→D的化学方程式.
解析:
| 答案:(1)2.0 mol·L-1 2.76 L
(2)
|
提示:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液。
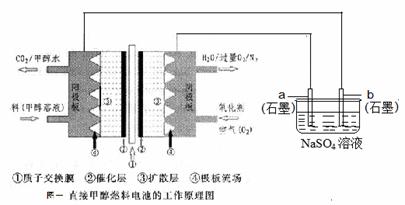 |
请根据图示回答下列问题:
(1)图中a电极是 (填“正极”、“负极”、“阴极”或“阳极”)。该电极上发生的电极反应式为 。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为 。
(3)当消耗3.36 L 氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是
。
(4)25℃、101kPa时,燃烧16g甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式: 。
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
|
①2SO2(g)+O2(g) ![]() 2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状态D时,![]()
![]() (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水。在25°C下,将a mol·L-1
的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中
显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时![]() )
)