题目内容
【题目】某同学设计如下图所示装置,用电解法把Na2CrO4溶液转变为Na2Cr2O7溶液(2CrO42-+2H+=Cr2O72-+H2O)。下列说法正确的是
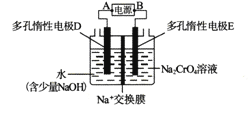
A. A为正极,B为负极
B. 电解过程中,电解槽左侧溶液pH增大
C. 电解过程中,Na+在电解槽中自左向右迁移
D. 当电路中通过lmol电子时,阴极生成0.5mol Na2Cr2O7
【答案】B
【解析】把Na2CrO4溶液转变为Na2Cr2O7溶液,需要增大溶液氢离子浓度。所以电解槽右侧为阳极电极反应生成氢离子,电极反应为![]() ;电解槽左侧为阴极,电极反应为
;电解槽左侧为阴极,电极反应为![]() ;A为负极,B为正极,故A错误;电解过程中,电解槽左侧生成氢氧根离子,溶液pH增大,故B正确;电解过程中,Na+在电解槽中自右向左迁移,故C错误;当电路中通过1mol电子时,阳极生成0.5mol Na2Cr2O7,故D错误。
;A为负极,B为正极,故A错误;电解过程中,电解槽左侧生成氢氧根离子,溶液pH增大,故B正确;电解过程中,Na+在电解槽中自右向左迁移,故C错误;当电路中通过1mol电子时,阳极生成0.5mol Na2Cr2O7,故D错误。

练习册系列答案
相关题目