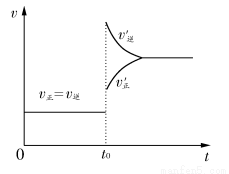
题目内容
短周期元素A、B、C、D位于同周期且原子序数依次增大。已知A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水。请完成下列各小题:
(1)A、B、C三种阳离子的半径由大到小的顺序是:____>_____>____(填写离子符号)。
(2)指出元素D在元素周期表中的位置:第________周期第________族。
(3)元素B的氧化物属于________化合物(填“离子”或“共价”),其电子式为________________。
(4)A、C元素的最高价氧化物所对应的水化物之间反应的离子方程式为________________。
(5)含有C阳离子的盐常用来净化水,其原因为______________(用离子方程式表示和适当的文字说明)。
(1)Na+ Mg2+ Al3+ (2)三 ⅥA
(3)离子 Mg2+[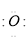 ]2-
]2-
(4)OH-+Al(OH)3=AlO2—+2H2O
(5)Al3++3H2O Al(OH)3+3H+,产生的氢氧化铝胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的。
Al(OH)3+3H+,产生的氢氧化铝胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的。
【解析】该题的突破口是A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水,说明它们分别是强酸、强碱及两性碱,所以该三种物质分别为钠、铝、硫中的一种,又因为A、C、D的原子序数依次增大,所以A为钠,C为铝,D为硫,则B为镁。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案某些化学键键能数据如下:
化学键 | H—H | Cl—Cl | H—Cl |
键能/ kJ·mol-1 | 436 | 243 | 431 |
则下列热化学方程式不正确的是( )
A. 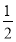 H2(g)+
H2(g)+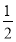 Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g)ΔH=-183 kJ·mol-1
C. 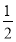 H2(g)+
H2(g)+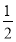 Cl2(g)=HCl(g)ΔH=+91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=+91.5 kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g)ΔH=+183 kJ·mol-1