题目内容
25 ℃时,用 2a mol?L-1 NaOH 溶液滴定 1.0 L 2a mol?L-1 氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示。下列说法正确的是( )
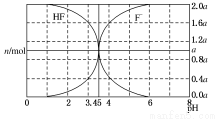
A. pH=3 时,溶液中: c(Na+)>c(F-)
B. c(F-)>c(HF)时,溶液一定呈碱性
C. pH=4 时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)< 2a mol?L-1
D. pH=3.45 时,NaOH 溶液恰好与 HF 完全反应
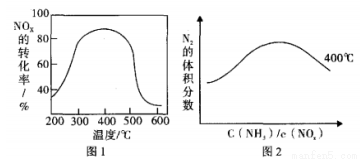
工业含铬(Cr)废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.废水pH与Cr2O72-转化为Cr3+的关系如图1,实验室模拟工业电解法处理含铬废水的装置如图2:
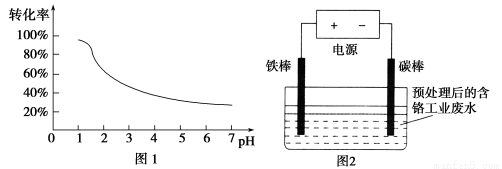
有关数据如下表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cr(OH)3 |
开始沉淀的pH | 1.9 | 7.5 | 4.3 |
完全沉淀的pH | 3.4 | 9.7 | 7.6 |
请根据以上知识回答下列问题:
(1)含铬废水预处理的方法是 。
(2)电解过程中阳极质量减小,阴极有气体产生,写出两极的电极反应式:
阳极 ,阴极 。
(3)写出Cr2O72-转化为Cr3+的离子方程式: 。
(4)每处理1molCr2O72-,外电路中转移 mol电子。
(5)电解过程中解液的pH (填增大、减小或不变)
(6)处理过程中,当废水颜色不再发生明显变化时,切断电源,取出电极。此时,溶液中的阳离子有Fe2+、Fe3+、Cr3+,若想用调节pH的方法得到纯净的Cr(OH)3沉淀,应先向溶液中加入适量的 ,再调节pH= ,过滤后继续调节pH= 8。
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
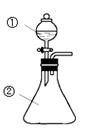
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液 | 酸性高锰酸钾溶液 | 溶液逐渐褪色 |


 5N2(g)+6H2O(g) △H1
5N2(g)+6H2O(g) △H1