��Ŀ����
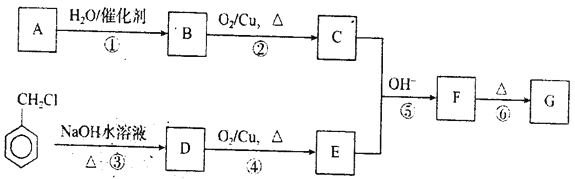
����Ŀ�������ڷǽ�������Ԫ��X��Y��Z��W��ԭ������������������ͼ��ʾ����ת����ϵ�У�l���ɸ�����Ԫ����ɵ����ӻ����m��Y�ĵ��ʣ�n��Z�ĵ��ʣ�p��W�ĵ��ʣ�����Ϊ�����������ֻ�����Ԫ����ɵĻ����u��ˮ��Һ����Ư���ԣ�����ʱ��0.01mol��L��1t��0.01mol��L��1 v��Һ��pH��Ϊ2��

��ش�
��1��X��Y��Z��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ____��
��2��l���·ֽ�ʱ���ƻ���������������____��
��3����l��W����ۣ���l��Һ�϶���____�ԣ������ӷ���ʽ��ʾ��ԭ��____��
��4��s+q��r+t��Ӧ�У���������s 13.8g����ת�Ƶĵ�����ĿΪ____��
��5��X��Y�γɵij���������ΪYX3��YX3����p���а��̲�����д�����ܵĻ�ѧ����ʽ__�������ʵ�鷽������ð��̵ijɷ�____��
��6��������YX2ZX��ˮ��Һ�������ԣ������£�����볣��Kb=9.0��10��9��0.10 mol��L��1�����ʵ���Һ��c(H+)Ϊ_____ mol��L��1��
���𰸡� N>O>H ���Ӽ������ۼ� ���� NH4++H2O![]() NH3��H2O+H+ 0.2NA 8NH3+3Cl2=6NH4Cl+N2 ȡ�����İ�����Ʒ�����ֳ����ݣ�һ�ݼ���NaOH�����ȣ���������ʹʪ���ɫʯ����ֽ����ɫ�����壬˵����NH4+����һ�ݼ�ˮ�ܽ⣬����AgNO3(HNO3)��Һ�����а�ɫ������������˵����Cl-���ɴ˿�֪�ð���ΪNH4Cl���� 3.3��10-10
NH3��H2O+H+ 0.2NA 8NH3+3Cl2=6NH4Cl+N2 ȡ�����İ�����Ʒ�����ֳ����ݣ�һ�ݼ���NaOH�����ȣ���������ʹʪ���ɫʯ����ֽ����ɫ�����壬˵����NH4+����һ�ݼ�ˮ�ܽ⣬����AgNO3(HNO3)��Һ�����а�ɫ������������˵����Cl-���ɴ˿�֪�ð���ΪNH4Cl���� 3.3��10-10
�������������Ϣ��m��n���ֵ��ʿ��ڷŵ������½��У�һ��Ϊ�����������ķ�Ӧ����rΪNO���ҿɼ�����n��Ӧ����mΪN2��nΪO2����֪YΪNԪ�أ�ZΪOԪ�أ�sΪNO2��qΪH2O��tΪHNO3������p��ˮ��Ӧ����u����Ư���ԣ���pΪCl2��uΪHClO��vΪHCl����WΪClԪ�أ���ԭ��������ϵ��֪XΪHԪ�أ�l�ֽ����ɵ�����������������ˮ����l��W����ۣ���lΪ������李�
(1)ͬ����ԭ�Ӵ�����ԭ�Ӱ뾶��С����ԭ�Ӱ뾶N��O��HΪԭ�Ӱ뾶��С��ԭ�ӣ�X��Y��Z��ԭ�Ӱ뾶�ɴ�С��˳��ΪN>O>H���ʴ�Ϊ��N>O>H��
(2)lΪ������������·ֽ�ʱ���ƻ������������������Ӽ������ۼ����ʴ�Ϊ�����Ӽ������ۼ���
(3)lΪ������泥�����ǿ�������Σ�ˮ�������ԣ�ˮ������ӷ���ʽΪNH4++H2O![]() NH3��H2O+H+���ʴ�Ϊ��NH4++H2O
NH3��H2O+H+���ʴ�Ϊ��NH4++H2O![]() NH3��H2O+H+��
NH3��H2O+H+��
(4)13.8g �������������ʵ���Ϊ![]() =0.3mol����3NO2 + H2O =2HNO3 + NO��Ӧ�У�0.3mol NO2ת�Ƶĵ���0.2mol����ĿΪ0.2NA���ʴ�Ϊ��0.2NA��
=0.3mol����3NO2 + H2O =2HNO3 + NO��Ӧ�У�0.3mol NO2ת�Ƶĵ���0.2mol����ĿΪ0.2NA���ʴ�Ϊ��0.2NA��
(5)NH3����Cl2���а��̲��������ܵĻ�ѧ����ʽΪ8NH3+3Cl2=6NH4Cl+N2��Ҫ������̵ijɷ�Ϊ�Ȼ�泥���Ҫ����笠����Ӻ������ӣ����岽��Ϊ��ȡ�����İ�����Ʒ�����ֳ����ݣ�һ�ݼ���NaOH�����ȣ���������ʹʪ���ɫʯ����ֽ����ɫ�����壬˵����NH4+����һ�ݼ�ˮ�ܽ⣬����AgNO3(HNO3)��Һ�����а�ɫ������������˵����Cl-���ɴ˿�֪�ð���ΪNH4Cl���壬�ʴ�Ϊ��8NH3+3Cl2=6NH4Cl+N2��ȡ�����İ�����Ʒ�����ֳ����ݣ�һ�ݼ���NaOH�����ȣ���������ʹʪ���ɫʯ����ֽ����ɫ�����壬˵����NH4+����һ�ݼ�ˮ�ܽ⣬����AgNO3(HNO3)��Һ�����а�ɫ������������˵����Cl-���ɴ˿�֪�ð���ΪNH4Cl���壻
(6)���뷽��ʽΪNH2OH![]() NH2++OH-������������볣��Kb=9.0��10��9����0.1molL-1NH2OHˮ��Һ��c(NH2+)=c(OH-)��K=
NH2++OH-������������볣��Kb=9.0��10��9����0.1molL-1NH2OHˮ��Һ��c(NH2+)=c(OH-)��K=![]() =
=![]() =9.0��10-9������c(OH-)=3��10-5mol/L����c(H+)=
=9.0��10-9������c(OH-)=3��10-5mol/L����c(H+)=![]() ��10-10mol/L���ʴ�Ϊ��3.3��10-10��
��10-10mol/L���ʴ�Ϊ��3.3��10-10��![]() ��10-10��
��10-10��

����Ŀ��ʵ������ȡ���ᶡ����ʵ��װ�������¼ס�������װ�ÿɹ�ѡ�á�

�Ʊ����ᶡ�����漰���й����ʵ��������ʼ��±���
���� | 1-���� | ���ᶡ�� | |
�۵㣨�棩 | 16.6 | -89.5 | -73.5 |
�е㣨�棩 | 117.9 | 117 | 126.3 |
�ܶȣ�g/cm3�� | 1.05 | 0.81 | 0.88 |
ˮ���� | ���� | ���ܣ�9g/100gˮ�� | �� |
��1������M������Ϊ_________��
��2����ȡ���ᶡ��ѡ����װ�ö���ѡ�ü�װ�õ�������__________��
��3�����Ʊ����ᶡ�����õĻ�����з��롢�ᴿ���ᶡ��ʱ����Ҫ�����ಽ����������ͼʾ�IJ����У��϶���Ҫ�Ļ�ѧ������______��ѡ��𰸱�ţ���

��4���л���ķ�������У�������Ҫʹ�÷�Һ©����������ʹ�÷�Һ©��ǰ����_____����д��������ijͬѧ�ڽ��з�Һ����ʱ��������Һ�����������������ԭ�����Һ©�����������⣬������_________��д��һ�㣩��