题目内容
黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的示意图如下:
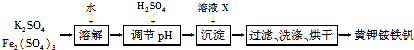
(1)溶液X是________。
(2)检验滤液中是否存在K+的操作是________________________。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾的化学式(写出计算过程)。

(1)溶液X是________。
(2)检验滤液中是否存在K+的操作是________________________。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾的化学式(写出计算过程)。
(1)氨水(或NH3·H2O);(2)用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察,若火焰呈紫色,则存在K+;
(3)黄钾铵铁矾的化学式为KNH4Fe6(SO4)4(OH)12。
(3)黄钾铵铁矾的化学式为KNH4Fe6(SO4)4(OH)12。
(1)制取黄钾铵铁矾的示意图及黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]组成,可以可知加入X是氨水,以便生成黄钾铵铁矾,
(2)通过焰色反应检验钾离子存在情况,方法为:用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察,若火焰呈紫色,则存在K+,
(3)②的沉淀为硫酸钡,硫酸钡的物质的量就等于溶液中硫酸根的物质的量:n(SO42-)=n(BaSO4)=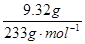 ="0.04" mol③所得气体为氨气,溶液中铵离子物质的量就等于氨气的物质的量:n(NH4+)=n(NH3)=
="0.04" mol③所得气体为氨气,溶液中铵离子物质的量就等于氨气的物质的量:n(NH4+)=n(NH3)= ="0.01" mol,④最终得到的固体是氧化铁,根据铁原子守恒,溶液中的铁离子物质的量为:n(Fe3+)=2n(Fe2O3)=2×
="0.01" mol,④最终得到的固体是氧化铁,根据铁原子守恒,溶液中的铁离子物质的量为:n(Fe3+)=2n(Fe2O3)=2× ="0.06" mol
="0.06" mol
黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]中,n(K+)=n(NH4+)="0.01" mol,
根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)="0.12" mol
n(K+):n(NH4+):n(Fe3+):n(SO42-):n(OH-)=1:1:6:4:12
黄钾铵铁矾的化学式为KNH4Fe6(SO4)4(OH)12,
(2)通过焰色反应检验钾离子存在情况,方法为:用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察,若火焰呈紫色,则存在K+,
(3)②的沉淀为硫酸钡,硫酸钡的物质的量就等于溶液中硫酸根的物质的量:n(SO42-)=n(BaSO4)=
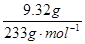 ="0.04" mol③所得气体为氨气,溶液中铵离子物质的量就等于氨气的物质的量:n(NH4+)=n(NH3)=
="0.04" mol③所得气体为氨气,溶液中铵离子物质的量就等于氨气的物质的量:n(NH4+)=n(NH3)= ="0.01" mol,④最终得到的固体是氧化铁,根据铁原子守恒,溶液中的铁离子物质的量为:n(Fe3+)=2n(Fe2O3)=2×
="0.01" mol,④最终得到的固体是氧化铁,根据铁原子守恒,溶液中的铁离子物质的量为:n(Fe3+)=2n(Fe2O3)=2× ="0.06" mol
="0.06" mol黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]中,n(K+)=n(NH4+)="0.01" mol,
根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)="0.12" mol
n(K+):n(NH4+):n(Fe3+):n(SO42-):n(OH-)=1:1:6:4:12
黄钾铵铁矾的化学式为KNH4Fe6(SO4)4(OH)12,

练习册系列答案
相关题目