题目内容
(1)若要配制100mL0.1mo1?L-1Na2SO4溶液,需称量Na2SO4的质量为______g.
(2)将2240mL氨完全溶于水配成100mL溶液,氨水中NH3的物质的量浓度为______mol?L-1.(不考虑NH3与H2O的反应)
(3)实验室里常用固体氯化铵与足量熟石灰加热制取氨.若需要2240mL(标准状况)氨,求至少需要氯化铵的质量.
解:(1)配制100mL0.1mo1?L-1Na2SO4溶液,需称量Na2SO4的质量为:0.1L×0.1mol/L×142g/mol≈1.4g,故答案为:1.4;
(2)2240mL氨气的物质的量为: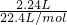 =0.1mol,
=0.1mol,
氨水的物质的量浓度为: =1mol/L,
=1mol/L,
故答案为:1;
(3)令生成2240mL(标准状况)氨气需要氯化铵的质量为mg,则:
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
107g 44.8L
mg 2.24L
所以107g:mg=44.8L:2.24L
解得:m=5.35
答:需要氯化铵5.35g.
分析:(1)根据n=cV计算硫酸钠的物质的量,再根据m=nM计算需要硫酸钠的质量;
(2)氨水溶质为氨气,根据n=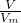 计算氨气的物质的量,再根据c=
计算氨气的物质的量,再根据c= 计算氨水的物质的量浓度;
计算氨水的物质的量浓度;
(3)令需要氯化铵的质量为mg,根据方程式2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O计算.
CaCl2+2NH3↑+2H2O计算.
点评:本题考查常用化学计量的有关计算、根据方程式的计算等,比较基础,注意基础知识的理解掌握.
(2)2240mL氨气的物质的量为:
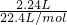 =0.1mol,
=0.1mol,氨水的物质的量浓度为:
 =1mol/L,
=1mol/L,故答案为:1;
(3)令生成2240mL(标准状况)氨气需要氯化铵的质量为mg,则:
2NH4Cl+Ca(OH)2
 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O107g 44.8L
mg 2.24L
所以107g:mg=44.8L:2.24L
解得:m=5.35
答:需要氯化铵5.35g.
分析:(1)根据n=cV计算硫酸钠的物质的量,再根据m=nM计算需要硫酸钠的质量;
(2)氨水溶质为氨气,根据n=
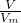 计算氨气的物质的量,再根据c=
计算氨气的物质的量,再根据c= 计算氨水的物质的量浓度;
计算氨水的物质的量浓度;(3)令需要氯化铵的质量为mg,根据方程式2NH4Cl+Ca(OH)2
 CaCl2+2NH3↑+2H2O计算.
CaCl2+2NH3↑+2H2O计算.点评:本题考查常用化学计量的有关计算、根据方程式的计算等,比较基础,注意基础知识的理解掌握.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
