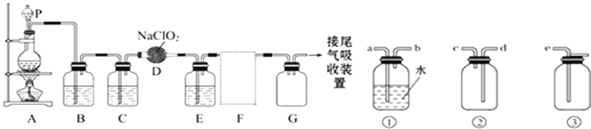
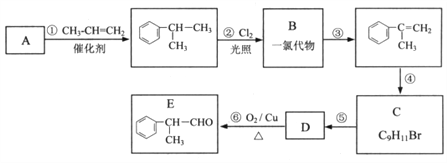
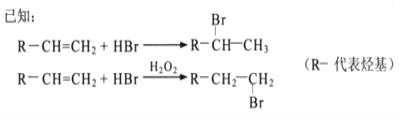
题目内容
【题目】实脸室取等物质的量的KClO3分别发生下述反应:
反应一:有催化剂存在时,受热分解得到氧气;
反应二:不使用催化剂,加热至743K左右,得到KClO4和KCl.
下列关子①和②的说法正确的是( )
A.两个反应中都只有一种元素化合价发生改变
B.两个过程生成KCl的物质的量相同
C.发生氧化反应的元素相同
D.发生还原反应的元素相同
【答案】D
【解析】解:①发生2KClO3 ![]() 2KCl+3O2↑,Cl元素的化合价降低,O元素的化合价升高;②发生4KClO3
2KCl+3O2↑,Cl元素的化合价降低,O元素的化合价升高;②发生4KClO3 ![]() 3KClO4+KCl,Cl元素的化合价既升高又降低,
3KClO4+KCl,Cl元素的化合价既升高又降低,
A.①中Cl、O元素发生化合价发生改变,②中Cl元素发生化合价发生改变,故A错误;
B.①中1molKClO3分解生成1molKCl,②中1molKClO3分解生成0.25molmolKCl,故B错误;
C.①中O元素发生氧化反应,②中Cl元素发生氧化反应,故C错误;
D.①中Cl元素的化合价降低发生氧化反应,②中Cl元素的化合价降低发生氧化反应,故D正确.
故选D.
①发生2KClO3 ![]() 2KCl+3O2↑,Cl元素的化合价降低,O元素的化合价升高;②发生4KClO3
2KCl+3O2↑,Cl元素的化合价降低,O元素的化合价升高;②发生4KClO3 ![]() 3KClO4+KCl,Cl元素的化合价既升高又降低,以此来解答
3KClO4+KCl,Cl元素的化合价既升高又降低,以此来解答

【题目】在Na+浓度为0.5molL﹣1的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子 | K+、Ag+、Mg2+ |
阴离子 | NO3﹣、CO32﹣、SiO32﹣、SO42﹣ |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 在Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
试回答下列问题:
(1)实验Ⅰ能确定一定不存在的离子是 .
(2)实验Ⅰ中生成沉淀的离子方程式为 .
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
阴离子 | NO3﹣ | CO32﹣ | SiO32﹣ | SO42﹣ |
c/molL﹣1 |
(4)判断原溶液中K+是否存在,若存在,求其最小物质的量浓度,若不存在,请说明理由: .