题目内容
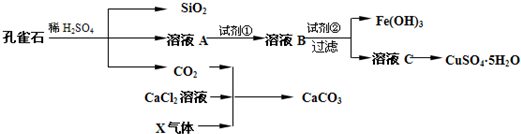
孔雀石主要成分Cu2(OH)2CO3,其中还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuSO4?5H2O及CaCO3的流程如下:
 请回答下列问题:
请回答下列问题:
(1)溶液A中含有的阳离子有______.实现由溶液A至溶液B转化的试剂①为______(填代号).
①.KMnO4 ②.(NH4)2S ③.O3 ④.浓硫酸 ⑤H2O2
(2)试剂②可以选用______(填代号)
A.Fe B.CuO C.Fe2O3 D.CuCO3 E.xCu(OH)2?yCuCO3 F.Cu(OH)2
(3)由CaCl2溶液制备CaCO3时,通入的气体X是______(填化学式).若实验过程中有X气体逸出,可选用下列______装置回收(填代号).

(4)欲测定溶液A中还原性金属阳离子的浓度,需要取A溶液配制进行氧化还原滴定.若选用KMnO4标准溶液进行滴定时应选用______滴定管(填“酸式”或“碱式”).滴定反应的离子方程式______
(5)由溶液C制取晶体的实验操作是______.
由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.
①KMnO4可以将Fe2+氧化为Fe3+,但引入K+、Mn2+等杂质,故①错误;
②(NH4)2S不能将Fe2+氧化为Fe3+,故②错误;
③O3可以将Fe2+氧化为Fe3+,且不引入新杂质,故③正确;
④浓硫酸加入溶液中,浓度变稀,不能将Fe2+氧化为Fe3+,故④错误;
⑤H2O2可以将Fe2+氧化为Fe3+,且不引入新杂质,故⑤正确.
故选:③⑤.
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,且不能引入新的杂质.
A.Fe与Fe3+反应,故A错误;
B.CuO中和H+,溶液pH增大,使Fe3+转化为Fe(OH)3,不引入杂质,故B正确;
C.Fe2O3中和H+,溶液pH增大,又引入Fe3+,故C错误;
D.CuCO3中和H+,溶液pH增大,使Fe3+转化为Fe(OH)3,不引入杂质,故D正确;
E.xCu(OH)2?yCuCO3 中和H+,溶液pH增大,使Fe3+转化为Fe(OH)3,不引入杂质,故E正确;
F.Cu(OH)2中和H+,溶液pH增大,使Fe3+转化为Fe(OH)3,不引入杂质,故F正确.
故选:BDEF.
(3)由工艺流程转化关系可知,加入X使溶液在碱性条件下反应,所以气体X应为碱性气体,故X为氨气.由于氨气极易溶于水,吸收应采取防倒吸装置(采取倒置漏斗或在吸收装置连接防倒吸安全瓶).
a、吸收装置前边连接防倒吸安全瓶,故a正确;
b、连接防倒吸的倒置漏斗,漏斗边缘紧贴液面,可以防止倒吸,故b正确;
c、连接的倒置漏斗,但漏斗全部在浸在液面下,不能起防止倒吸作用,故c错误;
d、多孔球全部在浸在液面下,不能起防止倒吸作用,故d错误.
故答案为:NH3;ab
(4)KMnO4溶液极易强氧化性,可以腐蚀碱式滴定管的橡皮管,使用KMnO4溶液时通常加酸,所以KMnO4溶液应放置酸式滴定管内.
溶液A中还原性金属阳离子为Fe2+,在酸性条件下,MnO4-+将Fe2+氧化为Fe3+,自身被还原为Mn2+,同时生成水.反应中Fe2+→Fe3+,铁元素化合价升高1价;MnO4-+→Mn2+,锰元素降低5价,化合价升降最小公倍数为5,故Fe2++系数为5,MnO4- 系数为1,根据元素守恒可知Mn2+与Fe3+系数分别为1、5,根据电荷守恒可知,H+其系数为2+3×5-[2×5-1]=8,根据H元素守恒可知H2O系数是4,所以反应离子方程式为5Fe2++1MnO4-+8H+=1Mn2++5Fe3++4H2O.
故答案为:酸式;5Fe2++1MnO4-+8H+=1Mn2++5Fe3++4H2O.
(5)由溶液到晶体需要加热蒸发、冷却结晶、过滤、洗涤、干燥等.
故答案为:加热蒸发、冷却结晶、过滤、洗涤、干燥.
分析:(1)孔雀石主要成分Cu2(OH)2CO3,其中还含少量Fe、Si的化合物.铁元素以+2、+3价存在,孔雀石与硫酸反应中,硫酸过量.
由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,且不能引入新的杂质.
(3)由工艺流程转化关系可知,应先向CaCl2溶液中加入碱性物质并且不引入新杂质,故气体X应为碱性气体,应为氨气,氨气极易溶于水,吸收应采取防倒吸装置(采取倒置漏斗或连接安全瓶).
(4)KMnO4溶液极易强氧化性,可以腐蚀碱式滴定管的橡皮管.溶液A中还原性金属阳离子为Fe2+,在酸性条件下,MnO4-+将Fe2+氧化为Fe3+,自身被还原为Mn2+,同时生成水.
(5)由溶液到晶体需要加热蒸发、冷却结晶、过滤、洗涤、干燥等.
点评:考察物质性质、氧化还原反应、对装置的理解评价、物质分离提纯除杂等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等.要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力.注意基础知识的全面掌握.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
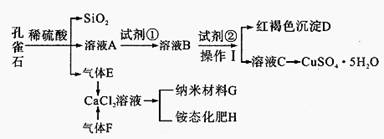
名师指导一卷通系列答案孔雀石主要含Cu2 (OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O及纳米材料G,主要步骤如下:
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如下:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
请回答下列问题:
(1)写出孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式 。
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。要检验其中的Fe2+应选择下列试剂中的 。
a.KMnO4 b.NaOH c.H2O2 d.KSCN
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,把Fe2+氧化成Fe3+的目的是 。该工厂选用试剂①最好为下列中的 (填代号)。
a.H2O2 b.空气 c.Cl2 d.KSCN
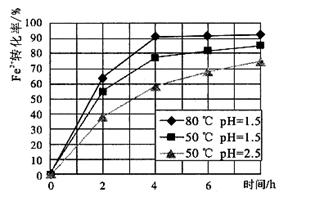
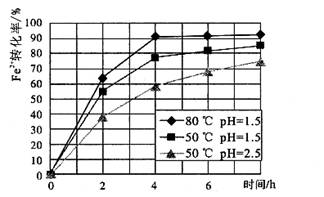
(4)根据下图有关数据,你认为工业上氧化操作时应采取的措施是 。
(5)向溶液B中加入试剂②的化学式为 ,操作I的名称是 。
(6)气体E和气体F应该先通人CaCl2溶液中的是 (填化学式)。写出制备G和H的化学反应方程式 。
(7)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-还原为Mn2+,则该反应的离子方程式为 。取A溶液20.00mL,用去0.0240mol/LKMnO4溶液16.00 mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为 。
孔雀石主要含Cu2 (OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5 H2O及纳米材料G,主要步骤如下:
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如下:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
(1)写出孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式 。
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。要检验其中的Fe2+应选择下列试剂中的 。
a.KMnO4 b.NaOH c.H2O2 d.KSCN
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,把Fe2+氧化成Fe3+的目的是 。该工厂选用试剂①最好为下列中的 (填代号)。
a.H2O2 b.空气 c.Cl2 d.KSCN
(4)根据下图有关数据,你认为工业上氧化操作时应采取的措施是 。
(5)向溶液B中加入试剂②的化学式为 ,操作I的名称是 。
(6)气体E和气体F应该先通人CaCl2溶液中的是 (填化学式)。写出制备G和H的化学反应方程式 。
(7)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-还原为Mn2+,则该反应的离子方程式为 。取A溶液20.00 mL,用去0.0240mol/LKMnO4溶液16.00 mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为 。
孔雀石主要含Cu2 (OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5 H2O及纳米材料G,主要步骤如下:
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如下:
|
物质 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe(OH)3 |
2.2 |
3.2 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Cu(OH)2 |
4.7 |
6.4 |
请回答下列问题:
(1)写出孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式 。
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。要检验其中的Fe2+应选择下列试剂中的 。
a.KMnO4 b.NaOH c.H2O2 d.KSCN
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,把Fe2+氧化成Fe3+的目的是 。该工厂选用试剂①最好为下列中的 (填代号)。
a.H2O2 b.空气 c.Cl2 d.KSCN
(4)根据下图有关数据,你认为工业上氧化操作时应采取的措施是 。
(5)向溶液B中加入试剂②的化学式为 ,操作I的名称是 。
(6)气体E和气体F应该先通人CaCl2溶液中的是 (填化学式)。写出制备G和H的化学反应方程式 。
(7)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-还原为Mn2+,则该反应的离子方程式为 。取A溶液20.00 mL,用去0.0240mol/LKMnO4溶液16.00 mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为 。
 请回答下列问题:
请回答下列问题: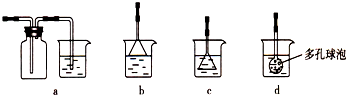
 请回答下列问题:
请回答下列问题: