��Ŀ����
����Ŀ���������ȼҵ����Ҫ��Ʒ֮һ������ǿ�������������л����������з�Ӧ���ɶ����Ȼ��ij��ȤС����ʵ�����ж����·�Ӧ������̽�����ش��������⣺
�����Ȼ���(BCl3)���Ʊ���

�������ϣ���֪����BCl3�ķе�Ϊ12.5 �棬�۵�Ϊ��107.3 �棻 ��2B��6HCl ![]() 2BCl3����3H2����
2BCl3����3H2����
��BCl3��ˮ�۲쵽�����İ�����
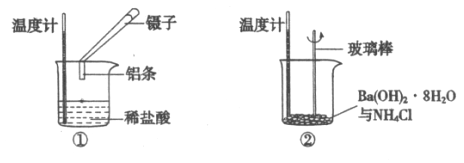
��1�����鷢��װ��A�������Ե�ʵ����巽����_____________________________________
��2���������������Ӹ�װ�õĽӿڣ�˳��Ϊ_______
a��( )��( )��( )��( )��( )��( )�� ( ) �� ( ) ��h��
��3��װ��D��������________________��װ��E��������___________________________��ʵ����������װ��C�����ܲ����ĺ����____________��
��4��BCl3��ˮ��Ӧ�Ļ�ѧ����ʽΪ��_____________________________��
��SO2��Ư�۾���Һ�ķ�Ӧ
���� | ���� |
ȡ4g Ư�۾����壬����100mL ˮ����Ư�۾���Һ��pH | pH ��ֽ�ȱ�����ԼΪ12��������ɫ |
| 1.Һ���Ϸ����ְ����� 2.�Ժ��ֻ��ǣ���Һ��Ϊ����ɫ�� 3.�Ժ���������ɫ����������ɫ��ȥ |
��5��pH��ֽ��ɫ�ı仯˵��Ư�۾���Һ���е�������_____________________________��
��6������2����Һ��Ϊ����ɫ��ԭ���ǣ�����Һ���Ե���ǿ��Ư�۾�����Ч�ɷֺ�Cl- ������Ӧ���÷�Ӧ�����ӷ���ʽΪ________________________��
��7�������ӷ���ʽ��������3�л���ɫ��ȥ��ԭ��_______________________��
���𰸡� �õ��ɼм�סa�����رշ�Һ©���Ļ��������Һ©���м�������ˮ��Ȼ���Һ©���Ļ������۲쵽ˮ���������������Σ�˵������������ e d j k b c(��cb) f g Һ��BCl3ʹ��ӻ�������з������ �������ȷ���Ⱦ�������ҷ�������ˮ��������D�� B��HCl��Ӧ����H2��H2��Cl2������ȷ�����ը BCl3��3H2O��3HCl��H3BO3 ���ԡ�Ư���� ClO��+Cl��+2H+=2H2O+Cl2�� SO2+Cl2+2H2O+Ca2+=CaSO4��+2Cl-+4H+(��SO2+Cl2+2H2O=SO42-+2Cl-+4H+)
�����������ڼ��������£��������̺�Ũ���ᷢ��������ԭ��Ӧ����Cl2����Ũ������лӷ��ԣ�ˮ������Ҳ�������������¶ȼӿ��Ȼ����ˮ�����ӷ����������ɵ�Cl2�к���HCl��H2O��Ũ���������ˮ�ԣ�����ʳ��ˮ������Cl2��Ũ�����ܸ������壬�Ӷ��õ��ϴ�����Cl2����B���Ƶ�BCl3��Ȼ����D�õ�BCl3���壬Ϊ��ֹC�е�ˮ��������Dװ��ʹ���ɵ�BCl3ˮ�⣬F��װŨ������и��E����δ��Ӧ��Cl2��
(1)���鷢��װ��A�������Ե�ʵ����巽�����õ��ɼм�סa�����رշ�Һ©���Ļ��������Һ©���м�������ˮ��Ȼ���Һ©���Ļ������۲쵽ˮ���������������Σ�˵�����������ã��ʴ�Ϊ���õ��ɼм�סa�����رշ�Һ©���Ļ��������Һ©���м�������ˮ��Ȼ���Һ©���Ļ������۲쵽ˮ���������������Σ�˵�����������ã�
(2)Ϊ���Ʊ�BCl3�����ݵ�ԭ����3Cl2+2B![]() 2BCl3������װ�����ӵ�˳��Ӧ��Ϊ���巢��װ��---����װ��--��Ӧװ��--�ռ�װ��--β������װ�õ�˳����ʵ�����Ʊ������м������Ȼ����ˮ����Ӧ�ȳ�ȥHCl�ٳ�ȥˮ���������������Ӹ�װ�õĽӿڣ�˳��Ϊa��e��d��j��k��b��c��f��g��h���ʴ�Ϊ�� e d j k b c(��cb) f g��
2BCl3������װ�����ӵ�˳��Ӧ��Ϊ���巢��װ��---����װ��--��Ӧװ��--�ռ�װ��--β������װ�õ�˳����ʵ�����Ʊ������м������Ȼ����ˮ����Ӧ�ȳ�ȥHCl�ٳ�ȥˮ���������������Ӹ�װ�õĽӿڣ�˳��Ϊa��e��d��j��k��b��c��f��g��h���ʴ�Ϊ�� e d j k b c(��cb) f g��
(3)���Ȼ���ķе�ͣ��ӷ�����Ҫ��ȴ��Ʒ��װ��D����Һ��BCl3ʹ��ӻ�������з��������װ��E��һ��ʢ�м�ʯ�ҵĸ���ܣ�������һ����������δ��Ӧ�Ķ�����������һ������Ҳ��ֹ�����е�ˮ��������U�ιܣ�Cװ��������Cl2�л��е�HCl�����������֪�������Ȼ��ⷴӦ���ɵIJ����������������������������Ļ�����壬������ը���ʴ�Ϊ����ȴ���ռ����Ȼ���������Ȼ��ⷴӦ���ɵIJ����������������������������Ļ�����壬������ը���ʴ�Ϊ��Һ��BCl3ʹ��ӻ�������з���������������ȷ���Ⱦ�������ҷ�������ˮ��������D�У�B��HCl��Ӧ����H2��H2��Cl2������ȷ�����ը��
(4)�����������������ƣ�����Ļ�ѧʽΪH3BO3����������(H3AlO3)�������Ȼ�����ˮ�ܷ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ��BCl3+3H2O=H3BO3+3HCl�����ʴ�Ϊ��BCl3+3H2O=H3BO3+3HCl����
����(5)pH��ֽ�ȱ���(ԼΪ12)��˵����Һ�ʼ��ԣ�����ɫ��ȥ��˵���־���Ư���ԣ��ʴ�Ϊ�����ԣ�Ư���ԣ�
(6)Ư�۾�����Ч�ɷ��Ǵ�����ƣ����������Cl- ����������ԭ��Ӧ������������Ӧ�����ӷ���ʽΪClO��+Cl��+2H+=2H2O+Cl2�����ʴ�Ϊ��ClO��+Cl��+2H+=2H2O+Cl2����
(7)��Һ�ʻ���ɫ����Cl2���ɣ�Cl2��SO2��Ӧ�������������ᣬ��Ӧ����ʽΪ��Cl2+SO2+2H2O=4H++2Cl-+SO42-�����������ˮ��Ҳ����д��SO2+Cl2+2H2O+Ca2+=CaSO4��+2Cl-+4H+���ʴ�Ϊ��Cl2+SO2+2H2O�T2Cl-+4H++SO42-(��SO2+Cl2+2H2O+Ca2+=CaSO4��+2Cl-+4H+)��

 ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�