题目内容
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①在元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。请填空:(1)Y、Z和W是否位于同一周期?______(填“是”或“否”),理由是_____________________________。
(2)Y是____________,Z是____________,W是____________。(写元素名称)
(3)Y原子的电子排布式为____________,Y、Z、W三种元素中电负性最大的是______(写元素符号,下同),Y和W分别与Z组成的化合物种类最多的是______。
(4)X、Y、Z和W可组成一离子化合物,其原子个数比为8∶2∶4∶1,写出该化合物的名称及化学式:____________。该化合物水溶液呈酸性的原因是________________________(用离子方程式表示)。
(1)否;如果位于同一周期,则最外层电子数之和应该是3的倍数,不可能为17
(2)氮;氧;硫
(3)1s22s22p3;O;N
(4)硫酸铵、(NH4)2SO4;
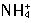 +H2O
+H2O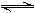 NH3?H2O+H+
NH3?H2O+H+【试题分析】

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的最高价氧化物对应的水化物化学式为H2XO3 |
|
Y |
Y是地壳中含量最高的元素 |
|
Z |
Z的基态原子最外层电子排布式为3s23p1 |
|
W |
W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25°、101kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
(5)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下: 2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
①反应物A的化学式为 ,属于 晶体
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如下图所示, 位于大立方体顶点和面心,
位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是
(填具体的微粒符号)
位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是
(填具体的微粒符号)
