题目内容
下列化学实验不符合“绿色化学”要求的是 ( )
| A.在萃取操作的演示实验中,将CCl4萃取溴水中的溴改为CCl4萃取碘水中的碘 |
| B.在铜和浓硝酸反应的实验中,将铜片改为可调节高度的铜丝 |
| C.将实验室的废酸液和废碱液中和后再排放 |
| D.将实验室用KMnO4固体加热分解制氧气后的残余物倒入下水道 |
D
解析试题分析:根据绿色化学实验的操作理念是无污染,如果有污染或浪费情况就不符合绿色化学实验的操作。
A.溴水易挥发、溴蒸气有毒。练习萃取操作时用碘水代替溴水能减少对实验室的污染,故A正确;
B.将铜片改为可调节高度的铜丝,可随时停止反应,能减少污染,故B正确;
C.将实验室的废酸液和废碱液中和后再排放,可以减少环境污染,因此选项C正确;
D.将实验室用KMnO4固体加热分解制氧气后的残余物中含有高锰酸钾、二氧化锰和锰酸钾,随意倾倒会造成环境污染,D不正确,答案选D。
考点:考查绿色化学的判断
点评:该题是高考中的常见题型,属于基础性试题的考查,有利于培养学生的环境保护意识和能源节约意识。要了解绿色化学、接受绿色化学,为环境保护做贡献。

用下列实验装置进行相应实验,能达到实验目的是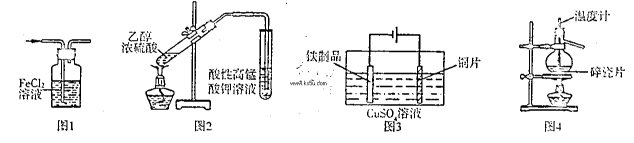
| A.用图1所示装置除去HCI气体中的少量C12 |
| B.用图2所示装置检验加热时产生的乙烯 |
| C.用图3所示装置在铁制品表面镀铜 |
| D.用图4所示装置分离溴的四氯化碳溶液 |
下列有关实验原理或实验操作正确的是
| A.用干燥pH试纸测定某新制氯水的pH |
| B.用图1装置能除去乙烷中混有的乙烯,得到纯净的乙烷 |
| C.用图2装置能验证HC1气体在水中的溶解性 |
| D.用25mL碱式滴定管量取20.00 mL KMnO4溶液 |
下面实验操作不能实现实验目的的是
| | 实验操作 | 目的 |
| A | 取绿豆大的钠分别加入到水和乙醇中 | 证明乙醇羟基中氢原子不如水分 子中氢原子活泼 |
| B | 取绿豆大的钠与钾分别投入水中 | 证明钾的金属性强于钠 |
| C | 将石蜡油在催化作用下,加强热产生的气 体通入溴的四氯化碳溶液中 | 证明产物不都是烷烃 |
| D | 蔗糖溶液加稀硫酸,水浴加热一段时间 后,加新制备的Cu(OH)2,加热 | 证明蔗糖水解后产生葡萄糖 |
下列有关实验的说法正确的是
| A.用pH试纸蘸取NaOH溶液,立刻与比色卡对比,测定NaOH溶液的Ph |
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀 |
| C.均不能采取将溶液直接蒸干的方法制得AIC13、A12(SO4)3、FeC13、Fe2(SO4)3 |
| D.滴定用的滴定管、锥形瓶和配制一定物质的量浓度溶液用的容量瓶,使用前均要润洗 |
由于易被氧化而不宜长期存放的溶液是
| A.氢硫酸 | B.硫酸钠溶液 | C.漂白粉 | D.浓硫酸 |
下列读数不正确的是( )
| A.用广泛pH试纸测得某溶液的pH为3.4 |
| B.用10 mL 量筒量取8.8 mL NaOH溶液 |
| C.用托盘天平称量7.9 g NaCl固体 |
| D.用酸式滴定管量取18.00 mL HCl |
草酸是一种重要的试剂。下面是利用草酸探究浓度对反应速率影响的实验。
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1 mol·L-1、0.2 mol·L-1 H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为: ;
预期现象是:
①溶液的颜色由 色变为 色,
②其中加入 mol·L-1H2C2O4的那支试管中的溶液先变色。
然而实验结果并不尽如人意。实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢。
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1 试验安排及结果
| 实验 编号 | A(KMnO4溶液浓度/mol·L-1) | B(草酸溶液浓度/mol·L-1) | C(硫酸溶液浓度/mol·L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
应用SPSS16.0对正交试验结果进行方差分析,结果如下表
表2 各因素水平的数据处理结果
| | A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | ||||||
| 浓度/mol·L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
(2)由表2可知,三因素中, 的浓度(选填“A、B或C”,下空同)对反应速率影响显著,而 的浓度对反应速率的影响不显著。
(3)由表2可知,当高锰酸钾浓度为 mol·L-1、草酸浓度为 mol·L-1时,反应最快。即因素A、B的较适宜实验条件得以确定。
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
| c(H2SO4)/mol·L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
(4)根据课堂实验的合适时间,可选溶液的褪色时间约为1分钟和2分钟的两份溶液,即此时硫酸的浓度为 mol·L-1和 mol·L-1,这也有利于观察这两个反应速率的差异。
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响。