题目内容
(1)
O2-中的质子数是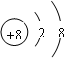
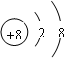
(2)写出下列元素的电子排布式
A题:
某原子3p轨道上得到1个电子后不能再容纳外来电子,其基态原子的电子排布式为:
某元素的正三价离子的3d轨道为半充满,其基态原子的电子排布式为:
B题:
Mg:
(3)画出下列元素的轨道表示式:C: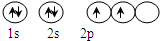
 N:
N:
 .
.
18 8 |
8
8
,中子数是10
10
,核外电子数是10
10
,质量数是18
18
,画出此微粒的离子结构示意图: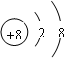
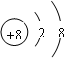
(2)写出下列元素的电子排布式
A题:
某原子3p轨道上得到1个电子后不能再容纳外来电子,其基态原子的电子排布式为:
1s22s22p63s23p5
1s22s22p63s23p5
某元素的正三价离子的3d轨道为半充满,其基态原子的电子排布式为:
1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
B题:
Mg:
[Ne]3s2
[Ne]3s2
K:[Ar]4s1
[Ar]4s1
Cr:[Ar]3d54s1
[Ar]3d54s1
(以原子实表示法表示).(3)画出下列元素的轨道表示式:C:




分析:(1)根据元素符号各个方向数字表示的含义判断,左下角表示质子数,左上角表示质量数,质子数+中子数=质量数,阴离子的电子数=质子数+电荷数;先判断该离子的核外电子,再画出其离子结构示意图;
(2)A题:根据核外电子排布规律,可知该原子的核外电子数为26,根据核外电子排布规律来写;
B题:根据原子实的表示方法;
(3)根据元素原子的电子轨道排布式来回答.
(2)A题:根据核外电子排布规律,可知该原子的核外电子数为26,根据核外电子排布规律来写;
B题:根据原子实的表示方法;
(3)根据元素原子的电子轨道排布式来回答.
解答:解:(1)
O2-中的质子数是8,质量数是18,;质子数+中子数=质量数,所以其中子数为10,阴离子的电子数=质子数+电荷数.所以其电子数为10,离子结构示意图为: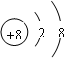 ,故答案为:8;8;10;
,故答案为:8;8;10;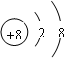 ;
;
(2)A题:根据核外电子排布规律,该基态原子的电子排布式为:1s22s22p63s23p5,故答案为:1s22s22p63s23p5;
元素的正三价离子的3d轨道为半充满,其基态原子的电子排布式为:1s22s22p63s23p63d64s2,为Fe,故答案为:1s22s22p63s23p63d64s2;
B题:Mg用原子实表示为:[Ne]3s2,K用原子实表示为:[Ar]4s1,Cr用原子实表示为:[Ar]3d54s1,故答案为:[Ne]3s2;[Ar]4s1;[Ar]3d54s1.
(3)C原子基态时的电子排布式为1s22s22p2,其电子的轨道表示式为: ;
;
N原子基态时的电子排布式为1s22s22p3,其电子的轨道表示式为: ,
,
故答案为: ;
; .
.
18 8 |
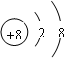 ,故答案为:8;8;10;
,故答案为:8;8;10;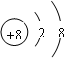 ;
;(2)A题:根据核外电子排布规律,该基态原子的电子排布式为:1s22s22p63s23p5,故答案为:1s22s22p63s23p5;
元素的正三价离子的3d轨道为半充满,其基态原子的电子排布式为:1s22s22p63s23p63d64s2,为Fe,故答案为:1s22s22p63s23p63d64s2;
B题:Mg用原子实表示为:[Ne]3s2,K用原子实表示为:[Ar]4s1,Cr用原子实表示为:[Ar]3d54s1,故答案为:[Ne]3s2;[Ar]4s1;[Ar]3d54s1.
(3)C原子基态时的电子排布式为1s22s22p2,其电子的轨道表示式为:
 ;
;N原子基态时的电子排布式为1s22s22p3,其电子的轨道表示式为:
 ,
,故答案为:
 ;
; .
.点评:本题主要考查了质量数、质子数之间的关系、电子排布式、轨道表示式的书写,难度不大,注意相关知识的积累.

练习册系列答案
相关题目