题目内容
硝酸工业尾气中氮的氧化物(NO、NO2)是主要的大气污染物之一.可用以下方法进行治理,其主要原理可表示如下:
2NO2+2NaOH![]() NaNO3+NaNO2+H2O
NaNO3+NaNO2+H2O
NO2+NO+2NaOH![]() 2NaNO2+H2O
2NaNO2+H2O
现有标准状况下a L NO2(其中占体积分数为20%的气体是N2O4)和b L NO混合气体,恰好可被200 mL NaOH溶液完全吸收.
(1)欲保证工业尾气全部被吸收,则a∶b的值应控制在________范围.
(2)NaOH溶液的物质的量浓度是________mol·L-1.
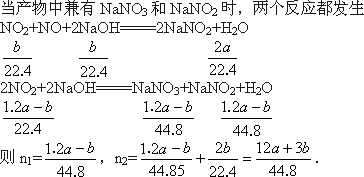
(3)试讨论a、b的值与生成的NaNO3和NaNO2物质的量(设分别为n1、n2)的比值之间的关系,当产物全部为NaNO2时,n1=________,n2=________;当产物中兼有NaNO3和NaNO2时,n1=________,n2=________.
(4)若在标准状况下有氮氧化物的混合物2.016 L恰好与50 mL 2.0 mol·L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4∶1,则在混合气体中N2O4和NO2的体积比为________.
解析:
|
答案:(1)≥5∶6 (2)(1.2a+b)/4.48 (3)0 (1.2a+b)/22.4 (1.2a-b)/44.8 (1.2a+3b)/44.8 (4)1∶5 解析:(1)分析两个化学方程式,用碱液吸收的NO2的体积不受限制,而NO的体积应小于或等于实际参加反应的NO2的体积,a L NO2中含体积分数为20%的N2O4,N2O4与NO2之间存在平衡N2O4 (2)用NOx表示氮氧化物的平均组成,从两个化学方程式可知n(NaOH)=n(NOx),则 (3)当产物全部为NaNO2时,只发生题中的后一个反应,n1=0,n2= (4)因n(NOx)=n(NaOH)=0.050 L×2.0 mol·L-1=0.10 mol,则当N2O4完全转化为NO2时,混合气的总体积应为0.10 mol×22.4 L·mol-1=2.24 L,现在的体积是2.016 L,说明在混合气中V(N2O4)=2.24 L-2.016 L=0.224 L.又因n(NaNO2)∶n(NaNO3)=4∶1,由化学方程式可推知n(NO)∶n(NO2)=1.5∶3.5=3∶7,则V(NO)=2.24 L× |