题目内容
【题目】物质中铁含量的测定方法是多种多样的.
土壤中铁含量的测定是先将Fe3+还原为Fe2+ , 然后使Fe3+与邻啡罗( 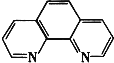 )结合显橙红色,再用比色法测定.其中涉及反应:4FeCl3+2NH2OHHCl═4FeCl2+N2O↑+6HCl+H2O
)结合显橙红色,再用比色法测定.其中涉及反应:4FeCl3+2NH2OHHCl═4FeCl2+N2O↑+6HCl+H2O
(1)基态Fe2+的核外电子排布式为。
(2)羟胺(NH2OH)中氮.氧原子的杂化方式是。
(3)羟胺的组成各元素中,元素的第一电离能(I1)由大到小的顺序为 (用元素符号表示)。
【答案】
(1)ls22s22p63s23p63d6或[Ar]3d6
(2)sp3
(3)N>O>H
【解析】:(1)铁是26号元素,铁原子核外有26个电子,铁原子失去3个电子变成铁离子,Fe3+在基态时,核外电子排布式为ls22s22p63s23p63d6或[Ar]3d6;所以答案是:ls22s22p63s23p63d6或[Ar]3d6;(2)羟胺(NH2OH)中,O原子的价层电子对数=2+(6-2×1)=4,所以采用sp3杂化,所以答案是:sp3;(3)羟胺含有N、H、O三种元素,根据元素周期律,非金属性强的元素第一电离能大,但由于第ⅤA族元素最外层p轨道是稳定结构,所以该族元素的第一电离能高于相邻同周期的元素,所以N、H、O的第一电离能由大到小的顺序为N>O>H,所以答案是:N>O>H。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3﹣、Cl﹣、NO | 不能大量共存, |
B | 由水电离出的H+浓度为1×10﹣12molL﹣1 | NH4+、Na+、NO | 一定能大量共存,NH4++H2ONH3H2O+H+ |
C | pH=1的溶液 | Fe2+、Al3+、SO | 不能大量共存,5Fe2++MnO4﹣+8H+═Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO﹣、SO | 不能大量共存,2ClO﹣+SO2+H2O═2HClO+SO |
A.A
B.B
C.C
D.D