题目内容
相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应说法正确的,下列是
| A.弱酸溶液产生较多的氢气 |
| B.强酸溶液产生较多的氢气 |
| C.两者产生等量的氢气 |
| D.无法比较两者产生氢气的量 |
A
解析试题分析:A.相同体积的pH=3的强酸溶液和弱酸溶液,弱酸的物质的量浓度较大,产生氢气多,故A正确;B.弱酸不能完全电离,随着反应的进行,弱酸进一步电离出氢离子,弱酸产生氢气多,强酸生成氢气少,故BCD错误;故选A.
考点:本题考查强弱电解质的电离

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
下列过程或现象与水解无关的是
| A.纯碱溶液能去油污 |
| B.配制氯化铁溶液时加入少量的盐酸 |
| C.加热稀醋酸溶液其pH稍有减小 |
| D.Na HCO3与Al2(SO4)3混合作泡沫灭火剂 |
常温下,关于0.1 mol/L NaHY溶液,下列叙述正确的是( )
| A.将NaHY晶体加入水中一定能促进水的电离 |
| B.若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c (Na+)>c (OH-)>c (H+)>c (HY-) |
| C.若溶液中c(H+)+c(H2Y)=c(OH-)+c(Y2-),则NaHY的水溶液一定显碱性 |
| D.若NaHY溶液的pH=4,该溶液中粒子浓度关系为:c (Na+)>c (HY-)>c (H+)>c (Y2-)>c (H2Y) |
某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 cm处; |
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)__________________________。
(2)上述B步骤操作的目的是__________________________________________。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果________(填“偏
高“、“偏低”或“不变”)。
(4)判断到达滴定终点的实验现象是________________________________________。
下列有关电解质溶液的叙述正确的是
| A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO) |
| D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
室温时,把10 mL pH=10的强碱溶液小心地加入到10 mL pH=4的某酸溶液中,在完全反应后的溶液中滴入紫色的石蕊试液时,溶液显红色,则此酸为( )
| A.一元强酸 | B.二元强酸 | C.任何强酸 | D.弱酸 |
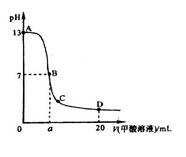
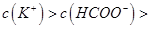
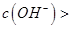
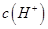
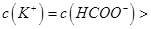
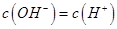 ,且a=7.5
,且a=7.5