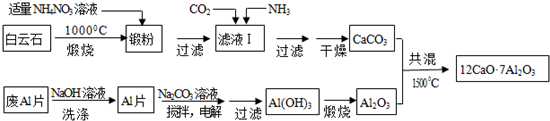
题目内容
19.某温度(t℃)时,水的离子积Kw=1×10-12,则该温度(填大于、小于或等于)大于25℃.在此温度下,将pH=a的Ba(OH)2溶液VaL与pH=b的H2SO4溶液VbL混合:(假设混合后溶液体积等于混合前两溶液体积之和,所得固体体积忽略不计)(1)若所得混合液为中性,且a=10,b=1,则Va:Vb=10:1,生成沉淀的质量为165Va(或11.65Vb).(最终结果可用含Va、Vb的表达式来表示)
(2)若所得混合液的pH=2,且a=10,b=1,则Va:Vb=9:2.
分析 常温下,水的离子积Kw=1×10-14,水的电离吸热,温度越高,水的电离程度越大,则水的离子积常数越大;
pH=b的H2SO4溶液中c(H+)=10-bmol/L,pH=a的Ba(OH)2溶液中c(OH-)=10 a-12mol/L,
在此温度下,将pH=a的Ba(OH)2溶液VaL与pH=b的H2SO4溶液VbL混合:(假设混合后溶液体积等于混合前两溶液体积之和,所得固体体积忽略不计)
(1)若所得混合液为中性,说明酸和碱恰好反应生成盐;
(2)若所得混合液的pH=2,根据混合溶液中氢离子浓度计算酸碱体积之比.
解答 解:温度越高,水的电离程度越大,则水的离子积常数越大,某温度(t℃)时,水的离子积Kw=1×10-12>10-14,
故答案为:大于;
(1)pH=b的H2SO4溶液中c(H+)=10-bmol/L,pH=a的Ba(OH)2溶液中c(OH-)=10 a-12mol/L,
若所得混合液为中性,则酸和碱恰好中和,a=10,b=1,10-1mol/L×VbL=1010-12mol/L×VaL
则Va:Vb=10:1,二者恰好反应生成硫酸钡和水,根据硫酸根离子守恒或钡离子守恒得硫酸钡的质量=0.5×10-2mol/L×VaL×233g/mol=1.165Vag或0.5×10-1mol/L×VbL×233g/mol=11.65Vbg,
故答案为:10:1;1.165Va或11.65Vb;
(2)若所得混合液的pH=2,10-2mol/L=$\frac{1{0}^{-1}×{V}_{b}-1{0}^{-2}{V}_{a}}{{V}_{a}+{V}_{b}}$mol/L,则Va:Vb=9:2,
故答案为:9:2.
点评 本题考查了离子浓度大小的比较、酸碱混合溶液定性判断,明确浓度与pH的换算、根据酸碱混合溶液中溶液酸碱性确定酸碱体积之比,题目难度中等.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案 ,CO的结构可以表示为
,CO的结构可以表示为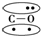 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有叁键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
| A. | 实验室可用丁达尔效应鉴别胶体与溶液 | |
| B. | 豆浆制豆腐是利用了胶体聚沉的原理 | |
| C. | 氢氧化铁胶体微粒带负电,通电时胶体微粒向直流动电源正极移动 | |
| D. | 配制氢氧化铁胶体时,可将饱和FeCl3溶液滴入沸水中 |
| A. | 豆浆中加入石膏制豆腐 | |
| B. | 晚上,打开手电筒看到一条明亮的光路 | |
| C. | 用“血透”法治疗肾病患者 | |
| D. | 二氧化碳使澄清石灰水变浑浊 |
| A. | Mg2+、NO3-、Cl-、Na+ | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | NH4+、NO3-、Al3+、CH3COO- | D. | MnO4-、K+、SO42-、Na+ |
| A. | 将粉末溶于水,加入Ba(NO3)2,再加过量盐酸,有白色沉淀生成不能证明原粉末被氧化 | |
| B. | 粉末在空气中变质被氧化的方程式:2K2SO3+O2═2K2SO4 | |
| C. | 将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明原粉末是K2SO4和K2SO3的混合物 | |
| D. | 元素分析表明粉末中K和S元素的质量比为39:16,推测该粉末为纯净物 |
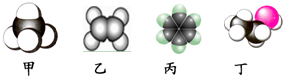
| A. | 甲是甲烷,甲烷能使酸性KMnO4溶液褪色 | |
| B. | 乙是乙烯,乙烯可与溴水发生取代反应使溴水褪色 | |
| C. | 丙是苯,苯在空气中燃烧时产生带有浓烟的火焰 | |
| D. | 丁是乙酸,一定条件下乙酸能跟乙醇发生取代反应 |

 ;写出X、Y之间反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2;
;写出X、Y之间反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2;