题目内容
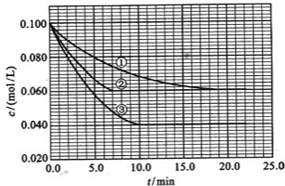
 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件是:②
加催化剂
加催化剂
;③温度升高
温度升高
;(2)实验②平衡时B的转化率为
40%
40%
;实验③化学平衡常数234.4(mol/L)-1
234.4(mol/L)-1
;(取三位有效数字)(3)该反应的△H
>
>
0,判断其理由是温度升高,平衡向正反应方向移动
温度升高,平衡向正反应方向移动
.分析:(1)在溶液中,压强对化学平衡无影响,且起始浓度不变,应为催化剂与温度对反应的影响,根据催化剂、温度对化学反应速度率和化学平衡的影响;
(2)由图可知,实验②平衡时A的浓度为0.06mol/L,计算A的浓度变化量,再利用方程式计算B的浓度变化量,进而计算平衡时B的转化率;
实验③平衡时A的浓度为0.04mol/L,计算A的浓度变化量,再利用方程式计算B、C的浓度变化量,及平衡时浓度,进而计算K;
(3)温度升高,A的浓度降低,平衡向正反应方向移动,据此判断.
(2)由图可知,实验②平衡时A的浓度为0.06mol/L,计算A的浓度变化量,再利用方程式计算B的浓度变化量,进而计算平衡时B的转化率;
实验③平衡时A的浓度为0.04mol/L,计算A的浓度变化量,再利用方程式计算B、C的浓度变化量,及平衡时浓度,进而计算K;
(3)温度升高,A的浓度降低,平衡向正反应方向移动,据此判断.
解答:解:(1)与①比较,②缩短达到平衡的时间,因催化剂能加快化学反应速度率,化学平衡不移动,所以②为使用催化剂;
与①比较,③缩短达到平衡的时间,平衡时A的浓度减小,因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,
故答案为:②加催化剂;③温度升高;
(2)由图可知,实验②平衡时A的浓度为0.06mol/L,故A的浓度变化量0.1mol/L-0.06mol/L=0.04mol/L,由方程式可知B的浓度变化量为0.04mol/L×2=0.08mol/L,故平衡时B的转化率为
×100%=40%;
实验③平衡时A的浓度为0.04mol/L,故A的浓度变化量0.1mol/L-0.04mol/L=0.06mol/L,由方程式可知B的浓度变化量为0.06mol/L×2=0.12mol/L,故平衡时B的浓度为0.2mol/L-0.12mol/L=0.08mol/L,由方程式可知C的浓度变化量为0.06mol/L,故平衡时C的浓度为0.06mol/L,则K=
=
=234.4(mol/L)-1
故答案为:40%;234.4(mol/L)-1;
(3)因③温度升高,平衡时A的浓度减小,化学平衡向吸热的方向移动,说明正反应方向吸热,即△H>0,
故答案为:>;温度升高,平衡向正反应方向移动.
与①比较,③缩短达到平衡的时间,平衡时A的浓度减小,因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,
故答案为:②加催化剂;③温度升高;
(2)由图可知,实验②平衡时A的浓度为0.06mol/L,故A的浓度变化量0.1mol/L-0.06mol/L=0.04mol/L,由方程式可知B的浓度变化量为0.04mol/L×2=0.08mol/L,故平衡时B的转化率为
| 0.08mol/L |
| 0.2mol/L |
实验③平衡时A的浓度为0.04mol/L,故A的浓度变化量0.1mol/L-0.04mol/L=0.06mol/L,由方程式可知B的浓度变化量为0.06mol/L×2=0.12mol/L,故平衡时B的浓度为0.2mol/L-0.12mol/L=0.08mol/L,由方程式可知C的浓度变化量为0.06mol/L,故平衡时C的浓度为0.06mol/L,则K=
| c(C) |
| c(A)c2(B) |
| 0.06mol/L |
| 0.04mol/L×(0.08mol/L)2 |
故答案为:40%;234.4(mol/L)-1;
(3)因③温度升高,平衡时A的浓度减小,化学平衡向吸热的方向移动,说明正反应方向吸热,即△H>0,
故答案为:>;温度升高,平衡向正反应方向移动.
点评:本题考查化学平衡浓度-时间图象、化学反应速率计算、化学平衡影响因素等,注意细心读取图象中物质的浓度,难度不大.

练习册系列答案
相关题目
 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=1.0mol/L,c(B)=2.0mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=1.0mol/L,c(B)=2.0mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题: 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.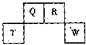 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: