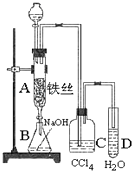
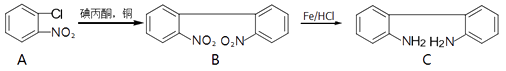
��Ŀ����
����Ŀ����COͨ�����з������Ժϳɼ״���
��CO2(g)��2H2O(l) === CH3OH(g)�� ![]() O2(g)����H1��+764.5 kJ��mol��1
O2(g)����H1��+764.5 kJ��mol��1
��CO(g)�� ![]() O2(g)===CO2(g)����H2����283.0 kJ��mol��1
O2(g)===CO2(g)����H2����283.0 kJ��mol��1
��H2(g)�� ![]() O2(g)===H2O(l)����H3����285.8 kJ��mol��1
O2(g)===H2O(l)����H3����285.8 kJ��mol��1
�����й�˵����ȷ���ǣ� ��
A.��Ӧ��ʹ�ô���������״�����
B.��Ӧ�����κ������¾����Է�����
C.��Ӧ����100��ʱ��H����285.8 kJ��mol��1
D.��ӦCO(g)��2H2(g) ![]() CH3OH(g)�Ħ�H����90.1 kJ��mol��1
CH3OH(g)�Ħ�H����90.1 kJ��mol��1
���𰸡�D
���������⣺A��ʹ�ô�����ֻ�ܸı仯ѧ��Ӧ���ʣ�����ʹƽ���ƶ�������B.��Ӧ�ڦ�H<0����S<0���ڵ����²����Է����У�����;C��100��ʱˮΪ��̬����ΪҺ̬ˮҪ�ų����������Դ�ʱ�ų��������١�H�����D���ݸ�˹���ɣ��ۡ���+�ٿɵ���CO��g��+2H2��g�� ![]() CH3OH��g����H =-90.1kJ��mol-1 �� ��ȷ��
CH3OH��g����H =-90.1kJ��mol-1 �� ��ȷ��
��ѡD��
�����㾫����������Ҫ�����˷�Ӧ�Ⱥ��ʱ�����֪ʶ�㣬��Ҫ�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�Ȳ�����ȷ�����⣮

����Ŀ��������Ⱦ������������Σ�������������ж�Ӧ��ϵ��ȷ���ǣ� ��
ѡ�� | �������� | ��ɻ����������Ҫ���� |
A | ���� | O3 |
B | ����ЧӦ | CO2 |
C | �ϼ�������ն� | SO3 |
D | �⻯ѧ���� | N2 |
A.A
B.B
C.C
D.D