题目内容
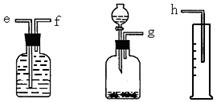
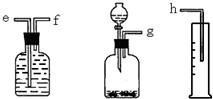 (1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
(1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
①用接口字母标出各仪器连接的顺序______量筒在实验中的作用是______
②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量分数是______.(假设在标准状况下测定)
(2) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
①人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是______(填序号).
A.亚硝酸盐被还原 B.维生素C具有还原性
C.维生素C将Fe3+还原为Fe2+D.在上述变化中亚硝酸盐是还原剂
②下列方法中,不能用来区分NaNO2和NaCl两种溶液的是______(填序号).
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
③某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:______.
④Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是______(填序号).
a.Cl2 b.Fe c.H2O2 d.HNO3
⑤配平下列方程式:□Fe(NO3)3+□KOH□Cl2→□K2FeO4+□KNO3+□KCl+□H2O.
解:(1)①钠溶于水生成氢气,因此可通过测量氢气的体积来计算钠的物质的量,所以正确的顺序是g-f-e-h.因此量筒的作用是测量气体的体积,
故答案为:g-f-e-h; 测量气体的体积;
②在量筒中收集到0.224L水,则生成氢气物质的量是0.01mol,根据电子守恒可知钠的物质的量是:0.02mol,质量是0.46g,所以钠的质量分数是: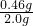 ×100%=23%,故答案为:23%;
×100%=23%,故答案为:23%;
(2)服用维生素C可解毒,这说明维生素C能把铁离子还原生成亚铁离子,所以维生素C具有还原性,
①A.亚硝酸盐氧化了亚铁离子,同时亚硝酸盐被还原,故A错误;
B.维生素C具有还原性,维生素C被三价铁离子氧化,具有还原性,故B错误;
C.服用维生素C可解毒,说明维生素C将Fe3+还原为Fe2+,故C错误;
D.在上述变化中亚硝酸盐是还原剂,亚硝酸盐能够氧化亚铁离子,具有氧化性,是氧化剂,故D正确;
故选D;
②A.测定这两种溶液的pH,亚硝酸钠是强碱弱酸盐,显示碱性,可以通过测定溶液的PH区别,故A错误;
B.分别在两种溶液中滴加甲基橙,甲基橙的变色范围是3.1~4.4,两种溶液都显黄色,无法区别,故B正确;
C.在酸性条件下加入KI-淀粉溶液来区别,亚硝酸钠具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,所以能够区别,故C错误;
D. 用AgNO3和HNO3两种试剂来区别,亚硝酸银不能溶于水,但能溶液硝酸中,而氯化银不能溶液硝酸中,所以能够区别,故D错误;
故选B.
③观察到氯水褪色,说明氯水被亚硝酸钠还原,再根据生成了NaNO3和HCl,反应的离子方程式是:NO2-+Cl2+H2O═NO3-+2H++2Cl-,
故答案为:NO2-+Cl2+H2O═NO3-+2H++2Cl-;
④由于Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确是双氧水,
故选c.
⑤根据方程式可知,铁元素的化合价从+3价升高到+6价,失去3个电子;氯元素的化合价从0价降低到-1价,得到1个电子,氯气反应化合价降低2价,最小公倍数是6,所以硝酸铁前面配2,氯气前面配3,再根据质量守恒配平其他物质,配平后的方程式为:2Fe(NO3)3+16KOH+3Cl2═2K2FeO4+6KNO3+6KCl+8H2O,
故答案为:2、16、3、2、6、6、8.
分析:(1)①钠溶于水生成氢气,因此可通过测量氢气的体积来计算钠的物质的量,所以正确的顺序是g-f-e-h.因此量筒的作用是测量气体的体积;
②在量筒中收集到0.224L水,则生成氢气是0.01mol,因此钠的物质的量是0.02mol,质量是0.46g,然后计算出钠的质量分数即可;
(2)①服用维生素C可解毒,这说明维生素C能把铁离子还原生成亚铁离子,所以维生素C具有还原性,据此进行分析;
②亚硝酸钠溶于水水解显碱性,而氯化钠溶于水显中性,选项A正确;甲基橙的变色范围是3.1~4.4,所以两种溶液都显黄色,选项B不正确;亚硝酸钠具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,选项C正确;亚硝酸银不能溶于水,但能溶液硝酸中,而氯化银不能溶液硝酸中,所以选项D正确;
③观察到氯水褪色,说明氯水被还原,同时生成NaNO3和HCl,根据反应物生成物写出反应的方程式;
④Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质;
⑤根据方程式可知,铁元素的化合价从+3价升高到+6价,失去3个电子;氯元素的化合价从0价降低到-1价,得到1个电子,然后根据电子的得失守恒和质量守恒定律配平方程式.
点评:本题考查了探究Na2O和Na的混合物中金属钠的含量及亚硝酸盐的性质,涉及了化学方程式的配平,可以根据题中信息及所学知识完成,本题难度中等.
故答案为:g-f-e-h; 测量气体的体积;
②在量筒中收集到0.224L水,则生成氢气物质的量是0.01mol,根据电子守恒可知钠的物质的量是:0.02mol,质量是0.46g,所以钠的质量分数是:
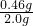 ×100%=23%,故答案为:23%;
×100%=23%,故答案为:23%;(2)服用维生素C可解毒,这说明维生素C能把铁离子还原生成亚铁离子,所以维生素C具有还原性,
①A.亚硝酸盐氧化了亚铁离子,同时亚硝酸盐被还原,故A错误;
B.维生素C具有还原性,维生素C被三价铁离子氧化,具有还原性,故B错误;
C.服用维生素C可解毒,说明维生素C将Fe3+还原为Fe2+,故C错误;
D.在上述变化中亚硝酸盐是还原剂,亚硝酸盐能够氧化亚铁离子,具有氧化性,是氧化剂,故D正确;
故选D;
②A.测定这两种溶液的pH,亚硝酸钠是强碱弱酸盐,显示碱性,可以通过测定溶液的PH区别,故A错误;
B.分别在两种溶液中滴加甲基橙,甲基橙的变色范围是3.1~4.4,两种溶液都显黄色,无法区别,故B正确;
C.在酸性条件下加入KI-淀粉溶液来区别,亚硝酸钠具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,所以能够区别,故C错误;
D. 用AgNO3和HNO3两种试剂来区别,亚硝酸银不能溶于水,但能溶液硝酸中,而氯化银不能溶液硝酸中,所以能够区别,故D错误;
故选B.
③观察到氯水褪色,说明氯水被亚硝酸钠还原,再根据生成了NaNO3和HCl,反应的离子方程式是:NO2-+Cl2+H2O═NO3-+2H++2Cl-,
故答案为:NO2-+Cl2+H2O═NO3-+2H++2Cl-;
④由于Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确是双氧水,
故选c.
⑤根据方程式可知,铁元素的化合价从+3价升高到+6价,失去3个电子;氯元素的化合价从0价降低到-1价,得到1个电子,氯气反应化合价降低2价,最小公倍数是6,所以硝酸铁前面配2,氯气前面配3,再根据质量守恒配平其他物质,配平后的方程式为:2Fe(NO3)3+16KOH+3Cl2═2K2FeO4+6KNO3+6KCl+8H2O,
故答案为:2、16、3、2、6、6、8.
分析:(1)①钠溶于水生成氢气,因此可通过测量氢气的体积来计算钠的物质的量,所以正确的顺序是g-f-e-h.因此量筒的作用是测量气体的体积;
②在量筒中收集到0.224L水,则生成氢气是0.01mol,因此钠的物质的量是0.02mol,质量是0.46g,然后计算出钠的质量分数即可;
(2)①服用维生素C可解毒,这说明维生素C能把铁离子还原生成亚铁离子,所以维生素C具有还原性,据此进行分析;
②亚硝酸钠溶于水水解显碱性,而氯化钠溶于水显中性,选项A正确;甲基橙的变色范围是3.1~4.4,所以两种溶液都显黄色,选项B不正确;亚硝酸钠具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,选项C正确;亚硝酸银不能溶于水,但能溶液硝酸中,而氯化银不能溶液硝酸中,所以选项D正确;
③观察到氯水褪色,说明氯水被还原,同时生成NaNO3和HCl,根据反应物生成物写出反应的方程式;
④Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质;
⑤根据方程式可知,铁元素的化合价从+3价升高到+6价,失去3个电子;氯元素的化合价从0价降低到-1价,得到1个电子,然后根据电子的得失守恒和质量守恒定律配平方程式.
点评:本题考查了探究Na2O和Na的混合物中金属钠的含量及亚硝酸盐的性质,涉及了化学方程式的配平,可以根据题中信息及所学知识完成,本题难度中等.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 (1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
(1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合: