题目内容
【题目】下列实验不能达到实验目的是( )
A.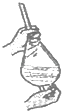
萃取时振荡分液漏斗
B.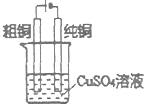
电解精炼铜
C.
铝热反应
D.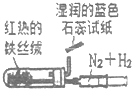
实验室模拟合成氨
【答案】D
【解析】解:A.萃取时,用左手握住分液漏斗活塞,右手压住分液漏斗口部,把分液漏斗倒转过来振荡,图示操作方法合理,能够达到实验目的,故A错误;
B.电解池中阳极失去电子发生氧化反应,阴极得到电子发生还原反应,所以电解精炼铜时纯铜做阳极,纯铜做阴极,电解质溶液为硫酸铜溶液,图示装置能够达到实验目的,故B错误;
C.铝在高温下能够与氧化亚铁发生铝热反应生成铁,图示装置能够达到实验目的,故C错误;
D.图示装置中使用“湿润的蓝色石蕊试纸”检验氨气,无法达到实验目的,应该为湿润的红色石蕊试纸检验,故D正确;
故选D.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目