题目内容
在1—18号元素中,部分连号元素单质的熔点情况如图3-37所示,试回答: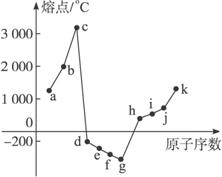
图3-37
(1)c点代表的单质可以是____________,其熔点高的主要原因是_____________________
____________________________________________________________________。
(2)d所属的晶体类型是____________________________。
解析:图中表示了11种连号元素单质熔点情况。由于c点的熔点在3
答案:(1)金刚石 金刚石是原子晶体,晶体中存在C—C共价键,键能很大,因此熔点很高
(2)分子晶体

原子核内无中子的原子 |
|
最外层只有1个电子的原子 |
|
最外层只有2个电子的原子 |
|
最外层电子数等于次外层电子数的原子 |
|
最外层电子数是次外层电子数2倍的原子 |
|
最外层电子数是次外层电子数3倍的原子 |
|
最外层电子数是次外层电子数4倍的原子 |
|
电子层数与最外层电子数相等的原子 |
|
电子层数为最外层电子数2倍的原子 |
|
次外层电子数是最外层电子数2倍的原子 |
|
内层电子总数是最外层电子数2倍的原子 |
|
在1—18号元素中,根据元素原子结构的特殊性填写下表:
| 原子核内无中子的原子 | |
| 最外层只有1个电子的原子 | |
| 最外层只有2个电子的原子 | |
| 最外层电子数等于次外层电子数的原子 | |
| 最外层电子数是次外层电子数2倍的原子 | |
| 最外层电子数是次外层电子数3倍的原子 | |
| 最外层电子数是次外层电子数4倍的原子 | |
| 电子层数与最外层电子数相等的原子 | |
| 电子层数为最外层电子数2倍的原子 | |
| 次外层电子数是最外层电子数2倍的原子 | |
| 内层电子总数是最外层电子数2倍的原子 |