题目内容
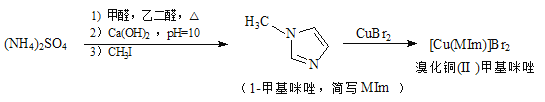
【题目】溴化铜(II)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
(1)铜元素位于周期表中第_____族,写出基态Cu2+的电子排布式_______。
(2)与NH4+互为等电子体的阴离子为_______。
(3)SO42-中心原子的杂化方式为_________。
(4)Mlm中含σ键与π数目之比为__________。
(5)一种铜的溴化物晶胞结构如下图所示。
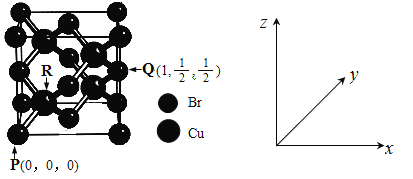
由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为______。

(6)Cu晶体的堆积方式如图所示,设Cu原子半径为a,晶体中Cu原子的配位数为____,晶体的空间利用率为__________。(列式计算)
【答案】 IB [Ar]3d9 BH4- sp3杂化 6:1 (![]() ) 12
) 12 ![]() (或74.76%)
(或74.76%)
【解析】(1)铜核电荷数为29,其电子排布式为[Ar]3d104s1,则铜元素位于周期表中第四周期第IB族,基态Cu2+的电子排布式IB;
(2)NH4+的原子数目为5,价电子总数为8,则与NH4+互为等电子体的阴离子为BH4-;
(3)SO42-中,价层电子对数=σ键个数+![]() (a-xb)=4+
(a-xb)=4+![]() (6+2-4×2)=4,含孤电子对数为0,杂化轨道数4,采取sp3杂化;
(6+2-4×2)=4,含孤电子对数为0,杂化轨道数4,采取sp3杂化;
(4)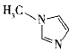 中双键数2,即π数目为2,单键数为12,即σ键数目为12,Mlm中含σ键与π数目之比为6:1;
中双键数2,即π数目为2,单键数为12,即σ键数目为12,Mlm中含σ键与π数目之比为6:1;
(5)图中P点坐标参数(0、0、0)和Q点原子坐标参数(1、![]() 、
、![]() ),可知晶胞边长设为1,PR点为晶胞对角线的
),可知晶胞边长设为1,PR点为晶胞对角线的![]() ,则可确定R点的原子坐标参数为(
,则可确定R点的原子坐标参数为(![]() ) ;
) ;
(6)晶胞中Cu原子位于面心、顶点上,属于面心立方最密堆积;
以顶点Cu原子研究,与之相邻的原子处于面心,每个顶点为8故晶胞共用,每个面心为2个晶胞共有,故Cu原子配位数为![]() =12;晶胞中Cu原子数目为8×
=12;晶胞中Cu原子数目为8×![]() +6×
+6×![]() =4,设Cu原子半径为d,则Cu原子总体积为4×
=4,设Cu原子半径为d,则Cu原子总体积为4×![]() πa3,晶胞棱长=4a×
πa3,晶胞棱长=4a×![]() =2
=2![]() a,晶胞体积为(2
a,晶胞体积为(2![]() a)3,晶胞空间利用率=(4×
a)3,晶胞空间利用率=(4×![]() πa3)÷((2
πa3)÷((2![]() a)3)×100%=
a)3)×100%= ![]() =74.76%。
=74.76%。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】在一定温度下,将气体X和Y各1.6mol充入10L恒容密闭容器中,发生如下反应:
X(g)+ Y(g)![]() 2Z(g),在反应过程中,X的物质的量与时间的关系如下表所示:
2Z(g),在反应过程中,X的物质的量与时间的关系如下表所示:
t/min | 0 | 2 | 4 | 6 | 8 | …… | 16 | 18 |
n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | …… | …… | 1.000 | 1.000 |
下列说法不正确的是( )
A. 4~6min时间段内Z的平均反应速率为2.5×10-3mol/(L·min)
B. 此温度下该反应的平衡常数K=1.44
C. 达平衡后,升高温度,![]() 减小,则正反应
减小,则正反应![]()
D. 若保持其他条件不变,再充入1.6mol Z,达新平衡后Z的体积分数不变